
【题目】由海水制备无水氯化镁,主要有以下步骤:①在一定条件下脱水干燥;②加熟石灰;③加盐酸;④过滤;⑤浓缩结晶.其先后顺序正确的是( )
A.②④⑤③①
B.③②④①⑤
C.③④②⑤①
D.②④③⑤①
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】对于化学电源的叙述正确的是
A. 化学电源比火力发电对化学能的利用率高
B. 化学电源所提供的电能居于人类社会现阶段总耗电量的首位
C. 化学电源均是安全、无污染的
D. 化学电源即为充电电池
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究大气中含硫化合物(主要是SO2和H2S)的转化对环境保护具有重要意义.
(1)SO2的大量排放会引起严重的环境问题是 , 潮湿条件下,写出大气中SO2转化为HSO3﹣的方程式 .
(2)土壤中的微生物可将大气中H2S经两步反应氧化成SO42﹣ , 两步反应的能量变化示意图1如下:
1mol H2S(g)全部氧化成SO42﹣(aq)的热化学方程式为
(3)SO2是工业制硫酸的原料气体之一,一定温度下,向容积为2L的密闭容器中充入一定量的SO2和O2 , 发生反应:2SO2(g)+O2(g)2SO3(g),过程中测定的部分数据见表:
时间/min | n(SO2)/mol | n(O2)/mol |
0 | 0.10 | 0.050 |
4 | 0.050 | 0.025 |
5 | 0.040 | |
8 | 0.020 |
①反应在0~4min内的平均速率为v(SO2)=;
②此温度下该反应的化学平衡常数K= ,
③8min时,维持温度不变,往反应容器中再通入0.020mol SO2(g),0.010mol O2(g),重新达到平衡时混合气体中SO2的百分含量将(填“减小”,“增大”或“不变”).(4)将H2S 和空气的混合气体通入FeCl3、FeCl2、CuCl2的混合溶液中反应回收S,其物质转化如图2所示:
①在温度一定和不补加溶液的条件下,缓慢通入混合气体,并充分搅拌.欲使生成的硫单质中不含CuS,可采取的措施有 .
②一般来说,如果一个反应的平衡常数大于105 , 通常认为反应进行得较完全;相反,如果一个反应的平衡常数小于10﹣5 , 则认为这个反应很难进行.已知常温下各物质的溶度积及电离平衡常数:
CuS:Ksp=6.3×10﹣36;H2S:K a1=1.3×10﹣7 , K a2=7.1×10﹣15 ,
通过计算说明反应CuS(s)+2H+ (aq)=Cu2+(aq)+H2S(aq)进行的程度 . 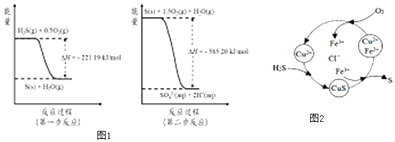
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于强、弱电解质的叙述不正确的是
A.强电解质在溶液中完全电离成阴、阳离子
B.强电解质溶液导电能力不一定比弱电解质溶液导电能力强
C.同一弱电解质同浓度的溶液,温度不同时,导电能力不同
D.强电解质易溶于水,弱电解质一定难溶于水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对三联苯是一种有机合成中间体,工业上合成对三联苯的化学方程式为3 ![]()
![]()
![]() +2H2↑.下列说法不正确的是( )
+2H2↑.下列说法不正确的是( )
A.上述反应属于取代反应
B.对三联苯分子中至少有16个原子共平面
C.对三联苯的一氯取代物有4种
D.0.2 mol对三联苯在足量的氧气中完全燃烧消耗5.1 mol O2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列检验方法与结论相符的一组是( )
序号 | 检 验 方 法 | 结 论 |
A | 向一种未知溶液中滴加AgNO3溶液,有白色沉淀 | 未知溶液中一定含有Cl﹣ |
B | 向一种未知溶液中滴加盐酸,有气泡产生 | 未知溶液中一定含有CO |
C | 将一种未知气体通入品红溶液,溶液褪色,加热后又恢复红色 | 未知气体是SO2 |
D | 向一种未知溶液中滴加BaCl2溶液,有白色沉淀 | 未知溶液中一定含有SO |
A.A
B.B
C.C
D.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:乙二酸俗称草酸(结构简式为HOOC—COOH,可简写为H2C2O4)。25℃时,草酸的电离平衡常数为K1=5.0×10-2,K2=5.4×10-5;碳酸(H2CO3)的电离平衡常数为K1=4.5×10-7,K2= 4.7×10-11。草酸钙的Ksp=4.0×10-8,碳酸钙的Ksp=2.5×10-9。回答下列问题:
(1)相同条件下等物质的量浓度的Na2C2O4溶液的pH比Na2CO3溶液的pH_____ (填“大”、“小”或“相等”);
(2)常温下将20 mL 0.4 mol/L的KOH溶液与20 mL 0.2 mol/L的草酸溶液混合,则混合后溶液中阴离子浓度的大小顺序为_______________________;
(3)25℃时向20 mL碳酸钙的饱和溶液中逐滴加入8.0×10-4 mol/L的草酸钾溶液20 mL,能否产生沉淀________(填“能”或“不能”).
(4)酸性KMnO4溶液能与草酸(H2C2O4)溶液反应,某探究小组利用反应过程中溶液紫色消失快慢的方法来研究影响反应速率的因素。
Ⅰ.实验前首先用浓度为0.1000molL-1酸性KMnO4标准溶液滴定未知浓度的草酸。
①高锰酸钾溶液常用______(填“稀硫酸”、“稀硝酸”、“稀盐酸”)酸化,写出滴定过程中发生反应的离子方程式 _____________________________。
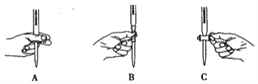
②滴定过程中操作滴定管的图示正确的是 ______________(填编号)。
①判断滴定终点的方法是:_________________________________________。
②若配制酸性KMnO4标准溶液时,俯视容量瓶的刻度线,会使测得的草酸溶液浓度________(填“偏高”或“偏低”或“不变”)。
Ⅱ.通过滴定实验得到草酸溶液的浓度为0.2000mol·L-1 。用该草酸溶液按下表进行后续实验(每次实验草酸溶液的用量均为8mL)。
实验编号 | 温 度(℃) | 催化剂用量(g) | 酸性高锰酸钾溶液 | 实验目的 a.实验1和2探究 b.实验1 和3 探究反应物浓度对该反应速率的影响; c.实验1 和4 探究催化剂对该反应速率的影响。 | |
体积(mL) | 浓度 (molL-1) | ||||
1 | 25 | 0.5 | 4 | 0.1000 | |
2 | 50 | 0.5 | 4 | 0.1000 | |
3 | 25 | 0.5 | 4 | 0.0100 | |
4 | 25 | 0 | 4 | 0.1000 | |
①写出表中a 对应的实验目的_______________________;
②该小组同学对实验1和3分别进行了三次实验,测得以下实验数据(从混合振荡均匀开始计时):
实验编号 | 溶液褪色所需时间(min) | ||
第1 次 | 第2 次 | 第3 次 | |
1 | 14.0 | 13.0 | 11.0 |
3 | 6.5 | 6.7 | 6.8 |
分析上述数据后得出“当其它条件相同时,酸性高锰酸钾溶液的浓度越小,褪色时间就越短,即反应速率就越快”的结论。某同学认为该小组“探究反应物浓度对速率影响”的实验方案设计中存在问题,从而得到了错误的实验结论,请简述改进的实验方案________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,下列选项不正确的是( )
A. 已知A-+H2B(过量)= HA+HB-,则水解能力:HB-<A-<B2-
B. 在0.1 mol/L氨水中滴加0.1 mol/L盐酸,恰好完全中和时溶液pH=a,则由水电离产生的c(OH-)=10-a mol/L
C. 在Na2SO3溶液中有: c(Na+)=2c(HSO3-)+2c(SO32-)+2c(H2SO3)
D. 欲除去CuCl2溶液中混有少量的FeCl3,可加入CuO
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】无水氯化铝是一种重要的化工原料,工业上利用明矾石制备无水氯化铝的流程如图,请回答下列问题: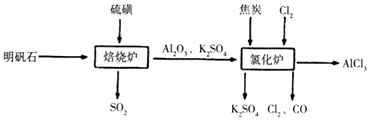
(1)实验室中,可制得Cl2的组合是(填代号).
①MnO2和浓盐酸混合共热 ②MnO2、NaCl和浓硫酸混合共热
③NaClO和盐酸混合共热 ④漂白粉和硫酸混合共热
(2)吸收焙烧炉中产生的尾气,下列装置合理的是(填代号).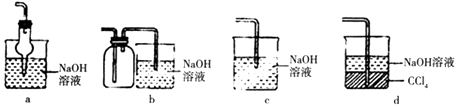
(3)写出氧化炉中反应的化学方程式
(4)生产氯化铝的过程中焙烧炉和氯化炉中产生的SO2、Cl2等大气污染物,若将二者按照一定比例通入水中可减少污染.试设计简单实验检验二者是否恰好完全反应,简要描述实验步骤、现象和结论(仪器自选).
可供选择试剂如下:
①滴加酚酞的氢氧化钠溶液 ②氯化亚铁溶液 ③硫氰化钾溶液 ④品红溶液
(5)某同学设计用如图装置验证二氧化硫的某些化学性质.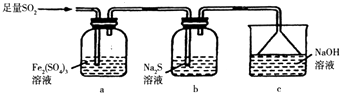
①能说明二氧化硫具有氧化性的实验现象为 .
②写出a瓶中发生反应的离子方程式 .
③充分反应后,取a瓶中的溶液分成三份,分别进行如下实验.
实验I:向第一份溶液中加入足量的NaOH溶液,生成白色沉淀,迅速变为灰绿色,最终变为红褐色.
实验II:向第二份溶液中加入少量KMnO4溶液,紫色褪去.
实验III:向第三份溶液中加入BaCl2溶液,生成白色沉淀.
上述实验中能充分证明二氧化硫具有还原性的是:(填实验代号).
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com