
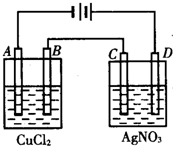
 如图为以惰性电极进行电解:
如图为以惰性电极进行电解:分析 (1)A与电源负极相连,为阴极,铜离子在阴极得到电子;B为阳极,氯离子在阳极失去电子;D与电源正极相连为阳极,则氢氧根离子在阳极失去电子;C为阴极,银离子在阴极得到电子;
(2)转移电子相同,结合4e-~2Cu~2Cl2~4Ag~O2计算;
(3)若ZnCl2-NH4Cl混合溶液中含有杂质Cu2+,Zn与Cu2+反应生成Cu,构成原电池会加速Zn电极的腐蚀;除去Cu2+,不能选择碱及引入杂质的物质,碱与锌离子也反应转化为沉淀.
解答 解:(1)由图可知,A、C为阴极,B、D为阳极,则A、B、C、D的电极反应分别为Cu2++2e-═Cu、2Cl--2e-═Cl2↑、2Ag++2e-═2Ag、4OH--4e-═2H2O+O2↑,
故答案为:Cu2++2e-═Cu;2Cl--2e-═Cl2↑;2Ag++2e-═2Ag;4OH--4e-═2H2O+O2↑;
(2)转移电子相同,由4e-~2Cu~2Cl2~4Ag~O2可知,若转移电子为4mol,A、B、C、D各电极上析出生成物的物质的量2mol、2mol、4mol、1mol,则A、B、C、D各电极上析出生成物的物质的量比为2:2:4:1,故答案为:2:2:4:1;
(3)若ZnCl2-NH4Cl混合溶液中含有杂质Cu2+,会加速某电极的腐蚀的原因为锌与还原出来的Cu构成铜锌原电池而加快锌的腐蚀;除去Cu2+,不能选择碱,碱与锌离子也反应转化为沉淀,不能选Fe会引入新杂质亚铁离子,则只有Zn符合,故答案为:锌与还原出来的Cu构成铜锌原电池而加快锌的腐蚀;b.
点评 本题考查电解原理及应用,为高频考点,把握电极判断、离子放电顺序、电极反应、电子守恒等为解答的关键,侧重分析与应用能力的考查,题目难度不大.


 暑假作业安徽少年儿童出版社系列答案
暑假作业安徽少年儿童出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | 分液、萃取、蒸馏 | B. | 萃取、蒸馏、分液 | C. | 分液、蒸馏、萃取 | D. | 蒸馏、萃取、分液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 CH3COOC2H5+H2O反应类型取代反应;
CH3COOC2H5+H2O反应类型取代反应; 反应类型加聚反应.
反应类型加聚反应.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1.0×10-3摩尔 | B. | 1.6×10-3摩尔 | C. | 2.2×10-3摩尔 | D. | 2.7×10-3摩尔 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氧化剂与还原剂的质量比为1:2 | |
| B. | NO2是氧化剂水是还原剂 | |
| C. | 生成1molNO则有6mol电子发生转移 | |
| D. | 氧化剂与还原剂的物质的量比为2:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Zn为正极,Ag2O为负极 | |
| B. | Zn为负极,Ag2O为正极 | |
| C. | 原电池工作时,正极区溶液pH值减小 | |
| D. | 原电池工作时,负极区溶液pH值增大 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com