
| A£® | øŗ¼«·“Ó¦Ź½£ŗAg-e-ØTAg+ | |
| B£® | ĆæÉś³É1mol Na2Mn5O10£¬MnO2ŌŚÕż¼«µĆµ½2molµē×Ó | |
| C£® | Na+²»¶ĻĻņ”°Ė®”±µē³ŲµÄøŗ¼«ŅĘ¶Æ | |
| D£® | AgClŹĒ»¹Ō²śĪļ |
·ÖĪö øł¾Żµē³Ų×Ü·“Ó¦æÉÅŠ¶Ļ³ö·“Ó¦ÖŠAgµÄ»ÆŗĻ¼ŪÉżøߣ¬±»Ńõ»Æ£¬AgÓ¦ĪŖŌµē³ŲµÄøŗ¼«£¬MnO2µĆµē×Ó×÷Õż¼«£»·½³ĢŹ½ÖŠAgÉś³ÉAgCl£¬»ÆŗĻ¼Ū¹²½µµĶĮĖ1¼Ū£¬ĖłŅŌĆæÉś³É2molAgCl×ŖŅĘ2 molµē×Ó£¬Ķ¬Ź±Éś³É1mol Na2Mn5O10£»ŌŚŌµē³ŲÖŠµē×Ó“Óøŗ¼«ĻņÕż¼«ŅĘ¶Æ£¬ŃōĄė×ÓĻņÕż¼«ŅĘ¶Æ£¬ŅõĄė×ÓĻņøŗ¼«ŅĘ¶Æ£¬ŅŌŠĪ³É±ÕŗĻµēĀ·£¬¾Ż“Ė·ÖĪö£®
½ā“š ½ā£ŗA£®Ņų·¢ÉśŃõ»Æ·“Ó¦£¬ÓėĀČĄė×Ó½įŗĻÉś³ÉĀČ»ÆŅų£¬ĖłŅŌøŗ¼«µÄµē¼¶·“Ó¦Ź½ĪŖ£ŗAg+Cl--e-=AgCl£¬¹ŹA“ķĪó£»
B£®ĆæÉś³É2molAgCl×ŖŅĘ2 molµē×Ó£¬Ķ¬Ź±Éś³É1mol Na2Mn5O10£¬ĖłŅŌĆæÉś³É1mol Na2Mn5O10£¬MnO2ŌŚÕż¼«µĆµ½2molµē×Ó£¬¹ŹBÕżČ·£»
C£®ŃōĄė×ÓĻņÕż¼«ŅĘ¶Æ£¬ĖłŅŌÄĘĄė×ÓĻņÕż¼«ŅĘ¶Æ£¬¹ŹC“ķĪó£»
D£®ĀČ»ÆŅųŹĒŃõ»Æ²śĪļ£¬¹ŹD“ķĪó£»
¹ŹŃ”B£®
µćĘĄ ±¾Ģāæ¼²éŌµē³ŲµÄµē¼«·“Ó¦ŗĶĄė×ӵĶØĻņŅʶÆŅŌ¼°µē»ÆѧµÄ¼ņµ„¼ĘĖć£¬×öĢāŹ±ŅŖ×¢Ņā×ܵē³Ų·“Ó¦Ź½µÄÅŠ¶ĻĄūÓĆ£¬ĢāÄæÄѶČÖŠµČ£®



| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ2016-2017ѧğĞĻÄĪĄŅ»øßŅ»ÉĻ10ŌĀŌĀæ¼»Æѧb¾ķ£Ø½āĪö°ę£© ĢāŠĶ£ŗŃ”ŌńĢā
ŹµŃéÖŠµÄĻĀĮŠ²Ł×÷ÕżČ·µÄ
A. ÓĆŹŌ¹ÜČ”³öŹŌ¼ĮĘæÖŠµÄNa2CO3ČÜŅŗ£¬·¢ĻÖČ”Įæ¹ż¶ą£¬ĪŖ²»ĄĖ·Ń£¬ÓÖ°Ń¹żĮæµÄŹŌ¼Įµ¹ČėŹŌ¼ĮĘæÖŠ
B. Ba(NO3)2ČÜÓŚĖ®£¬æɽ«ŗ¬ÓŠBa(NO3)2µÄ·ĻŅŗµ¹ČėĖ®²ŪÖŠ£¬ŌŁÓĆĖ®³åČėĻĀĖ®µĄ
C. ÓĆÕō·¢·½·ØŹ¹NaCl“ÓČÜŅŗÖŠĪö³öŹ±£¬Ó¦½«Õō·¢ĆóÖŠNaCl ČÜŅŗČ«²æ¼ÓČČÕōøÉ
D. ÓĆÅØĮņĖįÅäÖĘŅ»¶ØĪļÖŹµÄĮæÅØ¶ČµÄĻ”ĮņĖįŹ±£¬ÅØĮņĖįČÜÓŚĖ®ŗó£¬Ó¦ĄäČ“ÖĮŹŅĪĀ²ÅÄÜ×ŖŅʵ½ČŻĮæĘæÖŠ
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
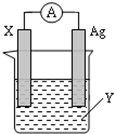 ŅĄ¾ŻŃõ»Æ»¹Ō·“Ó¦£ŗ2Ag+£Øaq£©+Zn£Øs£©ØTZn2+£Øaq£©+2Ag£Øs£© Éč¼ĘµÄŌµē³ŲČēĶ¼ĖłŹ¾£®
ŅĄ¾ŻŃõ»Æ»¹Ō·“Ó¦£ŗ2Ag+£Øaq£©+Zn£Øs£©ØTZn2+£Øaq£©+2Ag£Øs£© Éč¼ĘµÄŌµē³ŲČēĶ¼ĖłŹ¾£®²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | ±½”¢äåĖ®”¢Ģś·Ū»ģŗĻÖĘ³Éäå±½ | |
| B£® | ¼×ĶéÓėĀČĘų¹āÕÕÖĘµĆ“æ¾»µÄŅ»ĀČ¼×Ķé | |
| C£® | ÓĆøßĆĢĖį¼ŲČÜŅŗ³żČ„ŅŅĶéÖŠµÄŅŅĻ©ŌÓÖŹ | |
| D£® | æÉŅŌ²ÉČ”ÕōĮóµÄ·½·Ø£¬·ÖĄė±½ŗĶĻõ»ł±½ |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | 0.5Q2-1.5Q1-0.5Q3 | B£® | 0.5£ØQ1+Q2+Q3£© | ||
| C£® | 0.5 Q1-1.5 Q2+0.5Q3 | D£® | 1.5Q1-0.5Q2+0.5Q3 |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗĢīæÕĢā
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | ¶”ĶéµÄŅ»ĀČ“śĪļÓŠ5ÖÖ | B£® | ±ūĶé·Ö×ÓÖŠĖłÓŠŌ×Ó¹²Ę½Ćę | ||
| C£® | ·ūŗĻĶØŹ½CnH2n+2µÄ¾łŹōÓŚĶéĢž | D£® | ŅŌÉĻĖµ·Ø¾ł²»ÕżČ· |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
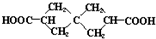 £ØŅ²æɱķŹ¾ĪŖ
£ØŅ²æɱķŹ¾ĪŖ £©ŹĒŅ»ÖÖÖŲŅŖµÄŅ©ĪļÖŠ¼äĢ壬ĻÖÓūĶعżČēĻĀĶ¾¾¶ŗĻ³É£ŗ
£©ŹĒŅ»ÖÖÖŲŅŖµÄŅ©ĪļÖŠ¼äĢ壬ĻÖÓūĶعżČēĻĀĶ¾¾¶ŗĻ³É£ŗ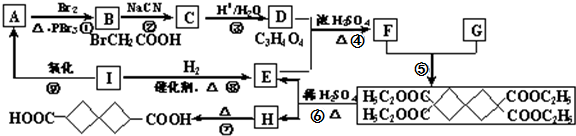
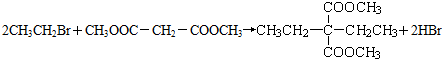
 £»øĆ·“Ó¦µÄĄąŠĶŹĒČ”“ś·“Ó¦»ņĖ®½ā·“Ó¦£®
£»øĆ·“Ó¦µÄĄąŠĶŹĒČ”“ś·“Ó¦»ņĖ®½ā·“Ó¦£® -COOH£¬ŌņXµÄ½į¹¹¼ņŹ½ĪŖBrCH2CH2Br£®
-COOH£¬ŌņXµÄ½į¹¹¼ņŹ½ĪŖBrCH2CH2Br£®²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗĶʶĻĢā
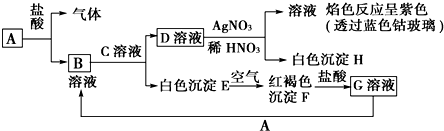
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com