
下列表示元素的基态原子的电子排布式,其中表示的元素属于第三周期的元素的是
A.1s22s1 B.1s22s22p5 C.1s22s22p63s2 D.1s22s22p63s23p64s1
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
将pH=3的盐酸a L分别与下列三种溶液混合后,混合液均呈中性
①b L 1×10-3mol·L-1的氨水 ②c L cOH-)=1×10-3mol·L-1的氨水 ③d L cOH-)=1×10-3mol·L-1的BaOH)2溶液,其中a、b、c、d的关系正确的是
)。
A.b>a=d>c B.a=b>c>d
C.a=b>d>c D.c>a=d>b
查看答案和解析>>
科目:高中化学 来源: 题型:
下列各组离子在指定环境中一定能大量共存的是( )
A.无色溶液中:K+、Fe2+、SO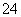 、CO
、CO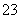
B.存在较多Fe3+的溶液中:Na+、Cl-、SO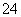 、H+
、H+
C.常温下由水电离出的c(H+)水·c(OH-)水=10-24的溶液中:NH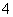 、Cl-、CO
、Cl-、CO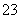 、F-
、F-
D.能使pH试纸变红的溶液中:K+、S2-、CO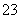 、NO
、NO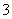
查看答案和解析>>
科目:高中化学 来源: 题型:
短周期主族元素X、Y、Z、W的原子序数依次增大,其中X、Y不同周期,Y与Z同主族,Z2-与Ar原子具有相同的电子层结构。下列说法正确的是( )
A.以上四种元素原子半径由大到小的顺序为W>Z>Y>X
B.Z、W的阴离子的还原性:Z>W
C.X分别与Y、Z形成的简单气态化合物的热稳性:Y<Z
D.Z的气态氢化物与其最高价氧化物的水化物能反应
查看答案和解析>>
科目:高中化学 来源: 题型:
已知H—H键能为436kJ·mol-1,N—H键能为391kJ·mol-1,根据化学方程式:N2+3H2 2NH3,1mol N2与足量H2反应放出的热量为92.4kJ·mol-1,那么N≡N键的键能是( )
2NH3,1mol N2与足量H2反应放出的热量为92.4kJ·mol-1,那么N≡N键的键能是( )
A.431kJ·mol-1 B.945.6kJ·mol-1 C.649kJ·mol-1 D.896kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
标准状况下有以下四种气体:①6.72 L CH4 ②3.01×1023个HCl分子 ③13.6 g H2S ④0.2 mol NH3。
(1)物质的量由小到大的顺序是____________。
(2)体积由小到大的顺序是____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
实验室用下列方法测定某水样中O2的含量。
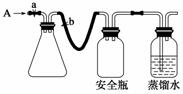
(1)实验原理
用如图所示装置,使溶解在水中的O2在碱性条件下将Mn2+氧化成MnO(OH)2,反应的离子方程式为____________________。
再用I-将生成的MnO(OH)2还原为Mn2+,反应的离子方程式为MnO(OH)2+2I-+4H+===Mn2++I2+3H2O。然后用Na2S2O3标准溶液滴定生成的I2,反应的化学方程式为I2+2Na2S2O3===2NaI+Na2S4O6。
(2)实验步骤
①打开止水夹a和b,从A处向装置内鼓入过量N2,此操作的目的是________;
②用注射器抽取某水样20.00 mL从A处注入锥形瓶;
③再分别从A处注入含m mol NaOH溶液及过量的MnSO4溶液;
④完成上述操作后,关闭a、b,将锥形瓶中溶液充分振荡;
⑤打开止水夹a、b,分别从A处注入足量NaI溶液及含n mol H2SO4的硫酸溶液;
⑥重复④的操作;
⑦取下锥形瓶,向其中加入2~3滴________作指示剂;
⑧用0.005 mol·L-1 Na2S2O3滴定至终点。
(3)数据分析
①若滴定过程中消耗的Na2S2O3标准溶液体积为3.90 mL,则此水样中氧(O2)的含量为________(单位:mg·L-1)。
②若未用Na2S2O3标准溶液润洗滴定管,则测得水样中O2的含量将________(填“偏大”、“偏小”或“不变”)。
③实验要求加入适量的H2SO4使溶液接近中性,其原因是____________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com