
【题目】已知X、Y均为有刺激性气味的气体,且几种物质间有以下转化关系,部分产物未标出。请回答下列问题。

(1)写出下列各物质的化学式:
X______、Y______、A______、B______、C______。
(2)反应①的离子方程式为____________。
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】下列装置由甲、乙两部分组成(如图所示),甲是将废水中乙二胺[H2N(CH2)2NH2]氧化为环境友好物质形成的化学电源;乙是利用装置甲模拟工业电解法来处理含Cr2O72-废水,电解过程中溶液发生反应:Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O。当电池工作时,下列说法错误的是
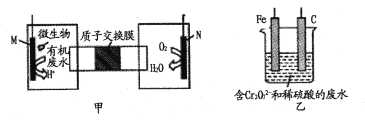
A. 甲中H+透过质子交换膜由左向右移动
B. 乙池中Fe棒应与甲池中的M极相连
C. M极电极反应式:H2N(CH2)2NH2+4H2O-16e-=2CO2↑+N2↑+16H+
D. 若溶液中减少了0.OlmolCr2O72-,则电路中至少转移了0.06 mol电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国科研人员提出了由CO2和CH4转化为高附加值产品CH3COOH的催化反应历程。该历程示意图如下。
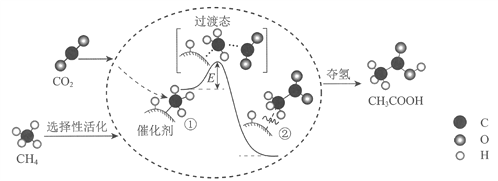
下列说法不正确的是
A. 生成CH3COOH总反应的原子利用率为100%
B. CH4→CH3COOH过程中,有C―H键发生断裂
C. ①→②放出能量并形成了C―C键
D. 该催化剂可有效提高反应物的平衡转化率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究化学反应是为了更好的利用化学反应。回答下列问题:
(1)在①置换反应 ②化合反应 ③分解反应 ④复分解反应 四种基本反应类型中,一定属于氧化还原反应的是_____________(填标号)。
(2)探究离子反应的实验装置如图。向滴有几滴酚酞的0.01 mol·L-1 Ba(OH)2溶液中逐滴滴入0.05mol·L-1 H2SO4溶液,直至过量。

①Ba(OH)2的电离方程式为__________;开始滴加0.05 mol·L-1 H2SO4时,反应的离子方程式为____________________;
②酚酞由红色变为无色时,观察到的实验现象还有____________。
(3)已知:a.向可溶性盐MnSO4的酸性溶液中加入 NaBiO3溶液,溶液变成紫红色,且有Bi3+离子生成;b.实验室常用高锰酸钾固体与浓盐酸在常温下反应制取氯气。
①写出a中反应的离子方程式________________________________;
②KMnO4、NaBiO3、Cl2的氧化性由强到弱的顺序为______________;
③某同学用盐酸酸化NaBiO3溶液,你认为是否合理,你的判定及理由是__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知镁在空气中燃烧主要生成氧化镁,同时还会与氮气反应生成微量的氮化镁(Mg3N2)在周期表中,镁与锂;铍与铝处于对角线上,处于对角线上的主族元素性质相 似,这称为对角线规则。据此请回答:
(1)锂在空气中燃烧主要产物的电子式是_____________同时生成微量的________。(写化学式)
(2)铍的最高价氧化物对应的水化物的化学式是_________________,它属两性化合物,证明这一结论的有关离子方程式为____________________,_____________________。
(3)若已知反应Be2C+4H2O===2Be(OH)2+CH4↑,则Al4C3遇强碱溶液反应的离子方程式为____________________________。
(4)用电子式表示BeCl2的形成过程:________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,向20mL 0.lmol·L-1H2A溶液中滴加0.lmol·L-1NaOH溶液,有关粒子物质的量的变化如图所示。下列有关说法正确的是( )
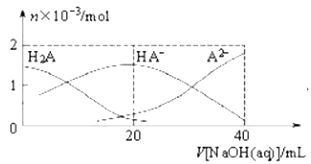
A. H2A在水中的第一步电离的电离方程式为:H2A=HA-+H+
B. c(HA-)/c(H2A)的比值随着V[NaOH(aq)]的增大而减小
C. V[NaOH(aq)]=20mL 时,溶液中存在关系:c(HA-)+c(A2-)+c(H2A)=0.1 mol·L-1
D. V[NaOH(aq)]=20mL 时,溶液中存在关系:c(Na+)>c(HA-)>c(H+)>c(A2-)>c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金属锰及化合物广泛应用于工业生产、制造业等领域。
(1)科研人员将锰粉碎后加入到![]() 溶液中使其浸出(假定杂质不反应,溶液体积不变),发生反应
溶液中使其浸出(假定杂质不反应,溶液体积不变),发生反应![]() (已知含
(已知含![]() 水溶液为米黄色)
水溶液为米黄色)
①为加快上述反应速率可以采取的措施有________________(写出一条即可)。
②下列说明反应已达平衡的有_______(填编号)。
A.溶液的颜色不发生变化
B.溶液中![]()
C.体系中固体的质量不变
D.![]() 与
与![]() 浓度的比值保持不变
浓度的比值保持不变
③室温下,测得溶液中阳离子浓度![]() 随时间的变化情况如下图所示,则上述反应的平衡常数K=________________,
随时间的变化情况如下图所示,则上述反应的平衡常数K=________________,![]() 的转化率为______________。
的转化率为______________。
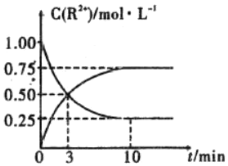
④若其他条件不变,10mim后向容器中迅速加入蒸馏水至溶液体积变为原来的2倍,则再次平衡时![]() =_____________(不考虑离子水解的影响)。
=_____________(不考虑离子水解的影响)。
(2)电解制锰后的废水中含有Mn2+,常用石灰乳进行一级沉降得到Mn(OH)2沉淀,过滤后再向滤液中加入等体积的Na2S溶液,进行二级沉降,为了将Mn2+的浓度降到![]() ,则加入的Na2S溶液的浓度至少是______________mol/L[已知
,则加入的Na2S溶液的浓度至少是______________mol/L[已知![]() ]
]
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室常用![]() 与浓盐酸反应制备
与浓盐酸反应制备![]() 。
。
(1)制备反应会因盐酸浓度下降面停止。为测定反应残余液中盐酸的浓度,探究小组同学提出下列实验方案:
甲方案:与足量![]() 溶液反应,称量生成的
溶液反应,称量生成的![]() 质量。
质量。
乙方案:采用酸碱中和滴定法测定。
丙方案:与己知量![]() (过量)反应,称量剩余的
(过量)反应,称量剩余的![]() 质量。
质量。
丁方案:与足量![]() 反应,测量生成的
反应,测量生成的![]() 体积。
体积。
继而进行下列判断和实验:
①判定甲方案不可行。现由是_________。
②进行乙方案实验;准确量取残余清液稀释一定倍数后作为试样。
a.量取试样![]() ,用
,用![]() 标准溶液滴定,选择的指示剂是____,消耗
标准溶液滴定,选择的指示剂是____,消耗![]() ,该次滴定测得试样中盐酸浓度为_______
,该次滴定测得试样中盐酸浓度为_______![]()
b._________,获得实验结果。
③判断两方案的实验结果________(填“偏大”、“偏小”或“准确”).
[已知:![]() 、
、![]() ]
]
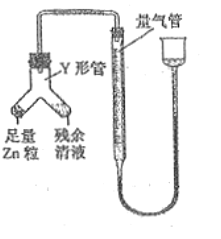
④进行丁方案实验:装置如图所示(夹持器具已略去)。
a.使Y形管中的残余清液与锌粒反应的正确操作是将_______转移到____中。
b.反应完毕,每间隔1分钟读取气体体积,气体体积逐次减小,直至不变。气体体积逐次减小的原因是__________(排除仪器和实验操作的影响因素),至体积不变时,量气管的左侧液面高于右侧液面,此时读数测得的体积__________(填“偏大”、“偏小”或“准确”)
(2)若没有酒精灯,也可以采用![]() 与浓盐酸反应制取适量氯气的如下简易装置。
与浓盐酸反应制取适量氯气的如下简易装置。
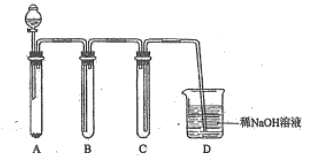
装置B、C、D的作用分别是:
B___________C______________D______________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上用氨气和氢气直接合成氨,并通过下列转化过程制备硝酸:
![]()
(1)上述物质中为红棕色气体的是____(填化学式);
(2)NH3溶于水所得溶液呈___(填“酸性”、 “碱性”或“中性” );
(3)配平NO2→HNO3的化学方程式:3NO2 +H2O = ___HNO3 + NO。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com