
【题目】900 ℃时,向2.0 L恒容密闭容器中充入0.40 mol乙苯,发生反应:
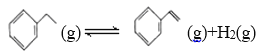
一段时间后,反应达到平衡,反应过程中测定的部分数据如下表所示:
时间/min | 0 | 10 | 20 | 30 | 40 |
n(乙苯)/mol | 0.40 | 0.30 | 0.24 | n2 | n3 |
n(苯乙烯)/mol | 0.00 | 0.10 | n1 | 0.20 | 0.20 |
下列说法正确的是
A.保持其他条件不变,向容器中充入不参与反应的水蒸气作为稀释剂,则乙苯的转化率大于50.0%
B.反应在前20 min内的平均反应速率v(H2)=0.008 mol·L-1·min-1
C.保持其他条件不变,向容器中充入不参与反应的水蒸气作为稀释剂,体系的总压增大,平衡时苯乙烷的分压也增加。
D.相同温度下,起始时向容器中充入0.10 mol乙苯、0.10 mol苯乙烯和0.30 mol H2,则达到平衡前:v正<v逆
【答案】D
【解析】
A.由表中数据可知,30min时处于平衡状态,平衡时苯乙烯的物质的量为0.2mol,由方程式可知,参加反应的乙苯的物质的量为0.2mol,故乙苯的转化率为:![]() ×100%=50%.保持其他条件不变,向容器中充入不参与反应的水蒸气作为稀释剂,反应混合物的浓度不变,平衡不移动,乙苯的转化率不变为50%,故A错误;
×100%=50%.保持其他条件不变,向容器中充入不参与反应的水蒸气作为稀释剂,反应混合物的浓度不变,平衡不移动,乙苯的转化率不变为50%,故A错误;
B.由表中数据可知,20min内乙苯的物质的量变化量为0.4mol-0.24mol=0.16mol,故v(乙苯)= =0.004molL-1min-1,速率之比等于化学计量数之比,则v(H2)=v(乙苯)=0.004molL-1min-1,故B错误;
=0.004molL-1min-1,速率之比等于化学计量数之比,则v(H2)=v(乙苯)=0.004molL-1min-1,故B错误;
C.保持其他条件不变,向容器中充入不参与反应的水蒸气作为稀释剂,平衡不移动,所以平衡时苯乙烷的物质的量不变,恒温、恒容条件气体的压强之比等于物质的量之比,所以苯乙烷的平衡分压不发生改变,故C错误;
D.由表中数据可知,30min时处于平衡状态,平衡时苯乙烯的物质的量为0.2mol,平衡时苯乙烯的浓度为![]() =0.1mol/L,由方程式可知,氢气的平衡浓度为0.1mol/L,参加反应的乙苯的物质的量为0.2mol,故平衡时乙苯的浓度为0.1mol/L,故平衡常数K=
=0.1mol/L,由方程式可知,氢气的平衡浓度为0.1mol/L,参加反应的乙苯的物质的量为0.2mol,故平衡时乙苯的浓度为0.1mol/L,故平衡常数K=![]() =0.1.相同温度下,起始时向容器中充入0.10mol乙苯、0.10mol苯乙烯和0.30molH2,此时浓度商Qc=
=0.1.相同温度下,起始时向容器中充入0.10mol乙苯、0.10mol苯乙烯和0.30molH2,此时浓度商Qc= =0.15> 0.1,反应向逆反应进行,故达到平衡前v正<v逆,故D正确;
=0.15> 0.1,反应向逆反应进行,故达到平衡前v正<v逆,故D正确;
故答案为D。


 优加精卷系列答案
优加精卷系列答案科目:高中化学 来源: 题型:
【题目】一定条件下,下列反应中水蒸气含量随反应时间的变化趋势符合题图10 的是
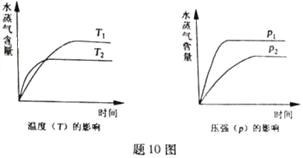
A. CO2(g)+2NH3(g)![]() CO(NH2)2(s)+H2O(g);△H<0
CO(NH2)2(s)+H2O(g);△H<0
B. CO2(g)+H2(g)![]() CO(g)+H2O(g);△H>0
CO(g)+H2O(g);△H>0
C. CH3CH2OH (g)![]() CH2=CH2(g)+H2O(g);△H>0
CH2=CH2(g)+H2O(g);△H>0
D. 2C6H5CH2CH3(g)+O2(g)![]() 2 C6H5CH=CH2(g)+2H2O(g);△H<0
2 C6H5CH=CH2(g)+2H2O(g);△H<0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各溶液中,Na+物质的量浓度最大的是( )
A. 4 L、0.5 mol·L-1NaCl溶液 B. 1 L、0.3 mol·L-1Na2SO4溶液
C. 5 L、0.4 mol·L-1NaOH溶液 D. 2 L、0.15 mol·L-1、Na3PO4溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某蓄电池放电、充电时的反应为:Fe+Ni2O3+3H2O![]() Fe(OH)2+2Ni(OH)2 下列推断中正确的是( )
Fe(OH)2+2Ni(OH)2 下列推断中正确的是( )
放电时,Fe为正极,Ni2O3为负极
②充电时,阴极上的电极反应式是:Fe(OH)2+2e-===Fe+2OH-
③充电时,Ni(OH)2为阳极
④该蓄电池的电极必须是浸在某种碱性电解质溶液中
A.①②③ B.②③④ C.①②④ D.①③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值。下列说法正确的是
A.金属和一定量的任意酸反应,只要放出2 g氢气,则转移的电子数为2NA
B.100 g 46%的乙醇水溶液中,含O—H键的数目为NA
C.48 g正丁烷和10 g异丁烷的混合物中共价键数目为11NA
D.含0.3 mol NH4NO3与a mol NH3·H2O的中性溶液中含0.3NA个NH![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图中A~L分别代表中学化学中的常见物质(部分反应的条件已略去)。A是一种常见氮肥,摩尔质量为79 g·mol-1。常温下,C是无色液体,E、L为常见金属单质,B、G、I、J、K为气体,其中D能使澄清的石灰水变浑浊,K呈红棕色。F为有磁性的黑色固体。
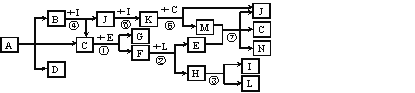
(1)A的化学式为____。
(2)写出反应④的化学方程式:____。
(3)写出反应①的化学方程式:____。
(4)若反应⑦中物质E过量,写出该反应的离子方程式:____。
(5)气体B或K直接排放到空气中会污染环境,在催化剂作用下两者会反应生成对环境无害的物质。写出该反应的方程式,并用单线桥表示电子转移的方向和数目:____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】羟氯喹是一种抗疟药物,被WHO支持用于新冠肺炎患者临床研究。某研究小组设计如下合成路线:
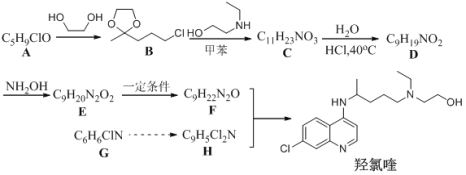
已知:
①
② ![]()
③
④苯环上连卤原子时,发生再取代反应主要生成邻、对位产物。
按要求回答下列问题:
(1)化合物A所含官能团的名称为___________________,化合物C的结构简式_______。
(2)下列说法正确的是___________________。
A. A到D过程中,乙二醇的作用是作为保护基团
B. 从合成路线推测,化合物B要密封干燥保存
C. E→F为加成反应
D. 羟氯喹的分子式为C18H26ClN3O
(3)D→E的化学方程式为____________________________。
(4)设计以苯为原料合成化合物G(用流程图表示,无机试剂任选)______________。
(5)写出同时符合下列条件的H的同分异构体的结构简式(不考虑立体异构):_______________。
1H-NMR和IR谱检测表明:
①苯环上有两种环境的不同氢,且两种氢的比例为2:1;②分子中含有氰基(-CN)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是( )
A.使用催化剂能够降低化学反应的反应热△H
B.CO(g)的燃烧热是283.0kJ/mol,则2CO2(g)=2CO(g)+O2(g)的ΔH=+2×283.0kJ/mol
C.需要加热才能发生的反应一定是吸热反应
D.HCl和NaOH反应的中和热ΔH=-57.3kJ/mol,则H2SO4和NH3.H2O反应的中和热ΔH=2(-57.3)kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某工业烟气中含有CO、CO2、N2、SO2等气体,用Na2SO3溶液吸收并回收SO2的过程如下图所示。

(1)SO2的浓度:I________II(填“>”或“<”)。
(2)在这个过程中可以循环使用的物质是________。
(3)上述吸收过程中主要反应的化学方程式是________。
(4)解吸过程需要加热,在这个过程中常伴有少量SO42-产生。
① 证明产物中含SO42-的实验方法是:取少量解吸产物的溶液,________(填操作和现象)。
② 产生SO42-的原因是_______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com