
在450 ℃并有催化剂存在下,于一容积恒定的密闭容器内进行下列反应:

2SO2(g)+O2(g)2SO3(g) ΔH=-190 kJ·mol-1
(1)该反应500 ℃时的平衡常数________450 ℃时的平衡常数(填“>”、“<”或“=”)。
(2)450 ℃时,在一2 L密闭容器中,将二氧化硫和氧化混合,反应过程中SO2、O2、SO3物质的量变化如图,反应处于平衡状态的时间是________________。
(3)据图判断,反应进行至20 min时,曲线发生变化的原因是__________________(用文字表达),10 min到15 min的曲线变化的原因可能是________(填字母)。
A.加了催化剂
B.缩小容器体积
C.降低温度
D.增加SO3物质的量
(4)欲提高SO2的转化率,下列措施可行的是________。(填字母)
a.向装置中再充入N2
b.向装置中再充入O2
c.改变反应的催化剂
d.升高温度
(5)利用图中数据计算450 ℃时反应进行至15 min时,SO2的平衡转化率为:________。
(6)450 ℃时,另一2 L容积不变的密闭容器中,测得某时刻各物质的量如下:
n(SO2)=0.4 mol,n(O2)=0.2 mol,n(SO3)=0.8 mol,则此时该反应向________进行(填“正反应方向”“逆反应方向”或“处于平衡状态”)。
解析 (1)该反应为放热反应,升高温度平衡逆向移动,平衡常数减小。
(2)平衡状态为各物质的浓度保持不变的状态,所以15~20 min和25~30 min这两个时间段,该反应处于平衡状态。
(3)20 min时O2的浓度从0.08 mol变成0.12 mol,而SO2、SO3的浓度未变,所以曲线变化的原因是增大了O2的浓度;观察10~15 min的曲线,可知:SO2、O2的物质的量继续减小,SO3的物质的量继续增加,但反应速率明显加快了,可能使用了催化剂,也可能缩小了容器的体积。
(4)欲提高SO2的转化率,应使平衡正向移动。
(5)φ(SO2)=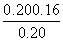 ×100%=20%。
×100%=20%。
(6)450 ℃时,该反应的平衡常数为:K=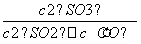 =
=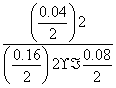 =1.56,而此时各物质的浓度商为:Qc=
=1.56,而此时各物质的浓度商为:Qc=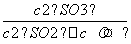 =
=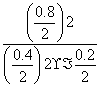 =40>K,所以该反应此时向逆反应方向进行。
=40>K,所以该反应此时向逆反应方向进行。
答案 (1)< (2)15~20 min和25~30 min (3)增大O2浓度(或通入O2) AB (4)b (5)20% (6)逆反应方向


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
青苹果汁遇碘水显蓝色,熟苹果汁能和银氨溶液反应析出银,这说明( )
A.青苹果只含淀粉不含糖类
B.熟苹果中只含糖类不含淀粉
C.苹果转熟时葡萄糖合成淀粉
D.苹果转熟时淀粉水解为葡萄糖
查看答案和解析>>
科目:高中化学 来源: 题型:
向体积为Va的0.05 mol·L-1 CH3COOH溶液中加入体积为Vb的0.05 mol·L-1 KOH溶液,下列关系错误的是( )
A.Va>Vb时:c(CH3COOH)+c(CH3COO-)>c(K+)
B. Va=Vb时:c(CH3COOH)+c(H+)=c(OH-)
C. Va<Vb时:c(CH3COO-)>c(K+)>c(OH-)>c(H+)
D. Va与Vb任意比时:c(K+)+c(H+)=c(OH-)+c(CH3COO-)
查看答案和解析>>
科目:高中化学 来源: 题型:
COCl2(g)CO(g)+Cl2(g) ΔH>0。当反应达到平衡时,下列措施:①升温 ②恒容通入惰性气体 ③增加CO的浓度 ④减压 ⑤加催化剂 ⑥恒压通入惰性气体,能提高COCl2转化率的是( )
A.①②④ B.①④⑥
C.②③⑥ D.③⑤⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
在一个固定容积的密闭容器中充入2 mol A和1 mol B,发生反应:2A(g)+B(g)xC(g),达到平衡后,C的体积分数为w%。若维持容器体积和温度不变,将0.6 mol A、0.3 mol B和1.4 mol C充入该容器中,达平衡后,C的体积分数也为w%,则x值为( )
A.只能为2
B.只能为3
C.可能是2,也可能是3
D.无法确定
查看答案和解析>>
科目:高中化学 来源: 题型:
根据碘与氢气反应的热化学方程式:
(ⅰ)I2(g)+H2(g)2HI(g)
ΔH=-9.48 kJ·mol-1
(ⅱ)I2(s)+H2(g)2HI(g)
ΔH=+26.48 kJ·mol-1
下列判断正确的是( )
A.254 g I2(g)中通入2 g H2(g),反应放热9.48 kJ
B.1 mol固态碘与1 mol气态碘所含的能量相差17.00 kJ
C.反应(ⅰ)的产物比反应(ⅱ)的产物稳定
D.反应(ⅱ)的反应物总能量比反应(ⅰ)的反应物总能量低
查看答案和解析>>
科目:高中化学 来源: 题型:
甲醇质子交换膜燃料电池中将甲醇蒸气转化为氢气的两种反应原理是( )
①CH3OH(g)+H2O(g)===CO2(g)+3H2(g) ΔH=+49.0 kJ·mol-1
②CH3OH(g)+ O2(g)===CO2(g)+2H2(g) ΔH=-192.9 kJ·mol-1
O2(g)===CO2(g)+2H2(g) ΔH=-192.9 kJ·mol-1
下列说法正确的是( )
A.CH3OH的标准燃烧热为-192.9 kJ·mol-1
B.反应①中的能量变化如图所示
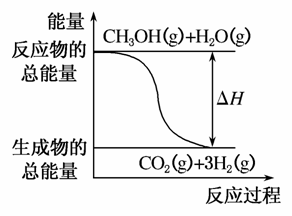
C.CH3OH转变成H2的过程一定要吸收能量
D.根据②推知反应CH3OH(l)+ O2(g)===CO2(g)+2H2(g)的ΔH>-192.9 kJ·mol-1
O2(g)===CO2(g)+2H2(g)的ΔH>-192.9 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
喷水溶液法是科学家近期研制出的一种使沙漠变绿洲的新技术。它是先在沙漠中喷洒一定量的聚丙烯酸酯(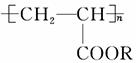 )“水溶液”,“水溶液”中的高分子化合物与沙土粒子相结合,在地表下30~50 cm处形成一个厚0.5 cm的隔水层,既能阻止地下的盐分上升,又有拦截蓄积雨水的作用。下列关于聚丙烯酸酯的说法中,不正确的是 ( )。
)“水溶液”,“水溶液”中的高分子化合物与沙土粒子相结合,在地表下30~50 cm处形成一个厚0.5 cm的隔水层,既能阻止地下的盐分上升,又有拦截蓄积雨水的作用。下列关于聚丙烯酸酯的说法中,不正确的是 ( )。
A.合成它的小分子化合物是CH3—CH2—COOR
B.它可由CH2==CH—COOR经过加成聚合反应而得到
C.在一定条件下能发生水解反应
D.不能发生加成反应
查看答案和解析>>
科目:高中化学 来源: 题型:
下列关于蛋白质和氨基酸的说法中,错误的是( )
A.蛋白质降解生成氨基酸属于分解反应
B.可用浓HNO3来鉴别蛋白质和淀粉
C.氨基酸既能与盐酸又能与氢氧化钠溶液反应
D.可采用渗析的方法来除去蛋白质溶液中的氨基酸
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com