
| Cu |
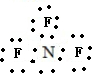 ;
; ;
;| C2(I 2) |
| C(TaI4)C(S2) |
| C2(I 2) |
| C(TaI4)C(S2) |
| ||
| 3min |


科目:高中化学 来源: 题型:
| A、由于氢键的作用,使NH3、H2O、HF的沸点反常,且沸点高低顺序为HF>H2O>NH3 |
| B、氢键只能存在于分子间,不能存在于分子内 |
| C、在固态水(冰)中,水分子间氢键数目增多,造成体积膨胀,密度减小 |
| D、相同量的水在气态、液态和固态时均有氢键,且氢键的数目依次增多 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
 中和热概念:酸与碱发生中和反应生成1mol H2O时释放的热量.已知
中和热概念:酸与碱发生中和反应生成1mol H2O时释放的热量.已知 查看答案和解析>>
科目:高中化学 来源: 题型:
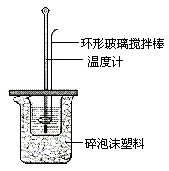 已知测定中和热的实验步骤如下:①量取30mL 0.5mol/L硫酸倒入小烧杯中,测量温度; ②量取50mL 0.5mol/L NaOH溶液,测量温度; ③将NaOH溶液倒入小烧杯中,混合均匀后测量混合液温度.回答下列问题
已知测定中和热的实验步骤如下:①量取30mL 0.5mol/L硫酸倒入小烧杯中,测量温度; ②量取50mL 0.5mol/L NaOH溶液,测量温度; ③将NaOH溶液倒入小烧杯中,混合均匀后测量混合液温度.回答下列问题查看答案和解析>>
科目:高中化学 来源: 题型:
 根据中和热的测定实验填空.
根据中和热的测定实验填空.查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、在c(HCO3-)=0.1mol?L-1的溶液中:NH4+、Al3+、Cl-、NO3- |
| B、在与铝反应放出氢气的溶液中:K+、SO42-、Br-、Na+ |
| C、25℃,在由水电离出的c(H+)=10-13mol?L-1的溶液中:NH4+、Al3+、SO42-、NO3- |
| D、在能使甲基橙变红的溶液中:K+、Fe2+、Cl-、NO3- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com