
| A.①③ | B.①④ | C.②③ | D.③④ |
 同步轻松练习系列答案
同步轻松练习系列答案 课课通课程标准思维方法与能力训练系列答案
课课通课程标准思维方法与能力训练系列答案科目:高中化学 来源:不详 题型:单选题
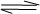 Z(g)经60s达到平衡,生成0.3molZ,下列说法正确的是
Z(g)经60s达到平衡,生成0.3molZ,下列说法正确的是 | A.以X浓度变化表示的反应速率为0.001mol/(L·s) |
B.将容器容积变为20L,Z的平衡浓度为原来的 |
| C.若增大压强,则正反应速率增大,逆反应速率减小 |
| D.若升高温度,X的体积分数增大,则该反应的△H<0 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
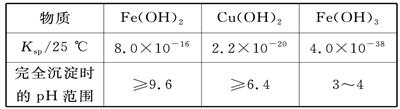
| A.向该混合溶液中逐滴加入NaOH溶液,最先看到红褐色沉淀 |
| B.向该溶液中加入适量氯水,并调节pH到3~4后过滤,可获得纯净的CuSO4溶液 |
| C.该溶液中c(SO)∶[c(Cu2+)+c(Fe2+)+c(Fe3+)]>5∶4 |
| D.在pH=5的溶液中Fe3+不能大量存在 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
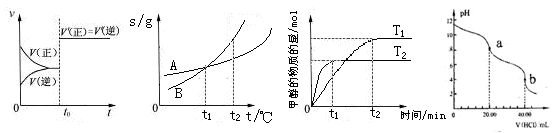 图4 图5 图6 图7
图4 图5 图6 图7查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题

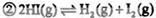
| A.9 | B.16 | C.20 | D.25 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
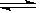 2SO3(g) ΔH=-196.6 kJ·mol-1
2SO3(g) ΔH=-196.6 kJ·mol-1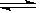 2NO2(g) ΔH=-113.0 kJ·mol-1
2NO2(g) ΔH=-113.0 kJ·mol-1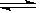 SO3(g)+NO(g)的ΔH= kJ·mol-1。
SO3(g)+NO(g)的ΔH= kJ·mol-1。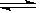 CH3OH(g)。
CH3OH(g)。
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.增大压强,活化分子百分数不变,化学反应速率增大 |
| B.升高温度,活化分子百分数增大,化学反应速率增大 |
| C.加入反应物,活化分子百分数增大,化学反应速率增大 |
| D.使用催化剂,活化分子百分数增大,化学反应速率增大 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com