
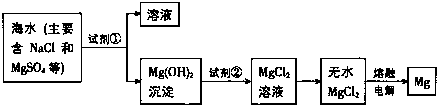
分析 (1)A.根据是否存在化合价的变化进行判断;
B.根据淡化海水的常用方法分析;
C.根据电解熔融氯化钠的原理分析;
D.根据能量转化的方式分析;
(2)氯气氧化性大于溴,氯气能够将溴离子氧化成溴单质;
(3)利用复分解反应及MgSO4转化为Mg(OH)2时阴离子的变化及实际生成需要考虑成本角度分析;分离固体和液体用过滤,利用溶解性的差异来分析;根据框图从氢氧化镁到氯化镁的反应分析;镁为活泼金属,常采用电解熔融状态的氯化镁制得镁,根据反应物和生成物以及反应条件写出化学方程式.
解答 解:(1)A.海水中含有的钾元素是以K+的形式存在,要转化为钾单质,钾元素必然降价,要发生还原反应,即只经过物理变化不能从海水中得到钾单质,故A错误;
B.目前淡化海水的方法有多种,如:蒸馏法、结晶法、淡化膜法、多级闪急蒸馏法等,故B正确;
C.从海水中得到氯化钠后,Na为活泼金属,则可以电解熔融状态的氯化钠生成氯气和金属钠,故C正确;
D.因朝汐发电是朝汐能转化为电能,故D错误;
故答案为:BC;
(2)氯气能氧化溴离子得到氯离子和单质溴,反应的离子方程式为:2Br-+Cl2═Br2+2Cl-,
故答案为:Cl2+2Br-=2Cl-+Br2;
2Br-+Cl2=Br2+2Cl-
(3)使MgSO4转化为Mg(OH)2,应选择碱,在转化中不引入新的离子,且从生成成本角度考虑,则试剂①选择Ca(OH)2或石灰乳,为了使镁离子完全转化,加入的试剂①应足量;
过滤适用于不溶于水的固体和液体,分离固体和液体用过滤,所以分离得到Mg(OH)2沉淀的方法是过滤;
从氢氧化镁到氯化镁,氢氧化镁和盐酸反应得到氯化镁和水,反应的化学方程式为:Mg(OH)2+2HCl=MgCl2+2H2O;
电解法制备镁要用无水MgCl2,不能用MgCl2•6H2O,否则得不到镁,无水氯化镁在熔融状态下,通过电解得到金属镁,化学方程式为:MgCl2(熔融)$\frac{\underline{\;电解\;}}{\;}$Mg+Cl2↑,
故答案为:Ca(OH)2或石灰乳;足量;过滤; 盐酸;MgCl2(熔融)$\frac{\underline{\;电解\;}}{\;}$Mg+Cl2↑.
点评 本题考查了海水资源的综合利用,题目难度中等,涉及海水中提取镁、溴的反应原理,利用所学知识结合流程图信息是解答本题的关键.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| A. | 同一周期中,碱金属元素的第一电离能最大 | |
| B. | 同周期元素中,ⅦA族元素的原子半径最大 | |
| C. | 当各轨道处于全满、半满、全空时原子较稳定 | |
| D. | ⅥA族元素的原子,其半径越大,越容易得到电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 三种元素对应的氧化物均为碱性氧化物 | |
| B. | 三者的单质长期放置在空气中均能被腐蚀 | |
| C. | 制备AlCl3、FeCl3、CuCl2均不能采用将溶液直接蒸干的方法 | |
| D. | 电解AlCl3、FeCl3、CuCl2的混合溶液时,阴极上依次析出Cu、Fe、Al |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将金属钠投入水中:Na+2H2O═Na++OH-+H2↑ | |
| B. | 过量CO2通人Ca(ClO)2溶液中:ClO-+CO2+H2O═HCO3-+HCIO | |
| C. | NH4HCO3溶液与过量的NaOH溶液反应:NH4++OH-═NH3↑+H2O | |
| D. | 铜片溶于稀硝酸中:Cu+4H++2NO3-═Cu2++2NO2↑+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Fe与S混合加热生成FeS2 | |
| B. | NaHCO3的热稳定性大于Na2CO3 | |
| C. | 白磷在空气中加热到一定温度能转化为红磷 | |
| D. | 过量的铜与稀硝酸反应有一氧化氮生成 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com