
【题目】下列图示与对应的叙述相符的是( )
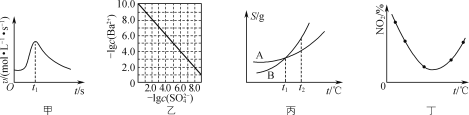
A.图甲表示镁条与盐酸反应的化学反应速率随反应时间变化的曲线,说明t1时刻溶液的温度最高
B.图乙表示室温下用Na2SO4除去溶液中Ba2+达到沉淀溶解平衡时,溶液中c(Ba2+)与c(![]() )的关系曲线,说明溶液中c(
)的关系曲线,说明溶液中c(![]() )越大c(Ba2+)越小
)越大c(Ba2+)越小
C.图丙表示A、B两物质的溶解度随温度变化情况,将t1 ℃时A、B的饱和溶液分别升温至t2 ℃时,溶质的质量分数w(B)>w(A)
D.图丁表示等量NO2在容积相同的恒容密闭容器中,不同温度下分别发生反应:2NO2(g)N2O4(g),相同时间后测得NO2含量的曲线,则该反应的ΔH>0
【答案】B
【解析】
A. 镁条与盐酸反应放热,温度升高反应速率加快,后来随着反应的进行,盐酸浓度减小,反应速率变慢,t1时刻反应速率最快,不能说明溶液的温度最高,镁与盐酸还在继续反应,温度还在升高,A错误;
B. 同一温度下,溶度积Ksp不变,溶液中c(![]() )越大,则c(Ba2+)越小,B正确;
)越大,则c(Ba2+)越小,B正确;
C. t1 ℃时A、B的溶解度相等,饱和溶液的溶质的质量分数相等,升温至t2 ℃时,溶解度增大,溶液为不饱和溶液,溶质没有变化,质量分数不变,所以:w(A)= w(B),C错误;
D. 图丁表示等量NO2在容积相同不同温度下分别发生反应,相同时间后测得NO2含量的曲线,由图可知,开始一段时间NO2的含量随温度升高而减小,这是因为温度升高反应速率加快,反应正向进行的程度逐渐增大,当NO2的含量达到最小值曲线的最低点时,该反应达到平衡状态,继续升高温度NO2的含量又逐渐增大,平衡逆向移动,根据勒夏特列原理,该反应逆反应是吸热反应,则正方向为放热反应,所以该反应的△H<0,D错误。
答案选B。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】完成下列电化学习题:
(1)某电池工作时的总反应可简化为:![]() ,电池中的固体电解质可传导Li+,则放电时,正极的电极反应式为________。充电时,Li+迁移方向为____(填“由左向右”或“由右向左”),图中聚合物隔膜应为____(填“阳”或“阴”)离子交换膜。
,电池中的固体电解质可传导Li+,则放电时,正极的电极反应式为________。充电时,Li+迁移方向为____(填“由左向右”或“由右向左”),图中聚合物隔膜应为____(填“阳”或“阴”)离子交换膜。

(2)使用间接电解法可处理燃煤烟气中的NO,装置如下图左。已知电解池的阴极室中溶液在pH在4~7(酸性)之间,试写出阴极的电极反应式______;用离子方程式表示吸收塔中除去NO的原理________。
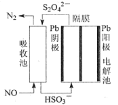
(3)某原电池装置如图所示,电池总反应为2Ag+Cl2=2AgCl。则负极反应为_______,放电时交换膜右侧溶液中酸性____(填“增强”、“减弱”或“不变”),若用KCl溶液代替盐酸,则电池总反应______(填“改变”或“不变”)。

(4)在生产和生活中采取了多种防止金属腐蚀的措施,利用原电池原理保护金属的方法是_______。
(5)纯锌与酸反应,为什么加入少许硫酸铜后会加速反应_________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物I是合成抗心律失常药普罗帕酮的前驱体,其合成路线如下:
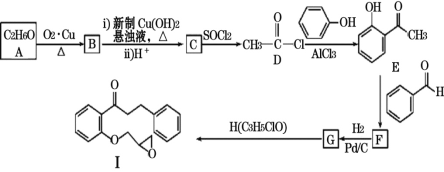
已知:CH3COCH3+CH3CHO![]() CH3COCH=CHCH3+H2O
CH3COCH=CHCH3+H2O
回答下列问题:
(1)A的名称_______。B的分子式为__________。
(2)A生成B的反应类型是_________;C生成D的反应类型是_________。
(3)F的结构简式为________;H的结构简式为________。
(4)化合物E中含有的两种官能团名称分别是________、_________;写出一种同时符合下列条件的E的同分异构体的结构简式:_____________。
①能发生银镜反应和水解反应
②核磁共振氢谱上显示4组峰
(5)参照上述合成路线,以2-丙醇和苯甲醛为原料(无机试剂任选),设计制备![]() 的合成路线:________
的合成路线:________![]()
![]() (补出前面两步)。
(补出前面两步)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在紫外线的作用下,氧气可生成臭氧:3O2![]() 2O3,一定条件下该反应达到平衡状态的标志是( )
2O3,一定条件下该反应达到平衡状态的标志是( )
A. 单位时间内生成2 mol O3,同时消耗3 mol O2
B. O2的消耗速率0.3 mol·L-1·s-1,O3的消耗速率0.2 mol·L-1·s-1
C. 容器内,2种气体O3、O2浓度相等
D. 气体密度不再改变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】正丁醚常用作有机反应的溶剂。实验室制备正丁醚的反应和主要实验装置如下:
2CH3CH2CH2CH2OH (CH3CH2CH2CH2)2O+H2O
(CH3CH2CH2CH2)2O+H2O

反应物和产物的相关数据如下:
相对分子质量 | 沸点/℃ | 密度/(g·cm-3) | 水中溶解性 | |
正丁醇 | 74 | 117.2 | 0.8109 | 微溶 |
正丁醚 | 130 | 142.0 | 0.7704 | 几乎不溶 |
合成反应:
①将一定量的浓硫酸和正丁醇,按一定顺序添加到A中,并加几粒沸石。
②加热A中反应液,迅速升温至135℃,维持反应一段时间。
分离提纯:
③待A中液体冷却后将其缓慢倒入盛有一定量水的分液漏斗中,振摇后静置,分液得粗产物。
④粗产物依次用蒸馏水、NaOH溶液和蒸馏水洗涤,分液后再加入一定质量的无水氯化钙颗粒,静置一段时间后弃去氯化钙。
⑤将上述处理过的粗产物进行蒸馏,收集馏分,得正丁醚。
请回答:
(1)步骤①中浓硫酸和正丁醇的添加顺序为________。
(2)加热A前,需先从________(填“a”或“b”)口向B中通入水。
(3)步骤②中,若温度控制不当,最容易产生副产物的结构简式为________。
(4)分液漏斗在使用前须清洗干净并________,步骤③中粗产物应从分液漏斗的________(填“上”或“下”)口分离出。
(5)步骤④中加入NaOH溶液洗涤的目的为________。
(6)步骤⑤中,加热蒸馏时应收集________(填选项字母)左右的馏分。
a.100℃ b.117℃ C.135℃ d.142℃
(7)反应过程中会观察到分水器中收集到液体物质,且分为上下两层,随着反应的进行,分水器中液体逐渐增多至充满时,上层液体会从左侧支管自动流回A。分水器中上层液体的主要成分为________,下层液体的主要成分为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,下列有关溶液中微粒的物质的量浓度关系正确的是( )
A.c(![]() )相等的(NH4)2SO4、NH4HSO4、NH4Cl溶液中:c(NH4HSO4)>c[(NH4)2SO4]>c(NH4Cl)
)相等的(NH4)2SO4、NH4HSO4、NH4Cl溶液中:c(NH4HSO4)>c[(NH4)2SO4]>c(NH4Cl)
B.将等体积、等物质的量浓度的NH4HCO3与NaCl溶液混合,析出部分NaHCO3晶体后的溶液中:c(H+)+c(H2CO3)=c(OH-)+c(![]() )+c(NH3·H2O)
)+c(NH3·H2O)
C.溶液X:10 mL 0.1 mol·L-1 NaCl;溶液Y:10 mL 0.1 mol·L-1 CH3COONa,则:X中离子总浓度>Y中离子总浓度
D.少量的氯气通入过量冷的0.1 mol·L-1NaOH溶液中:c(Na+)=c(HClO)+c(ClO-)+c(Cl-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,A是可用来对自来水进行消毒的黄绿色单质气体,A、B、C、D、E都含X元素,其转化关系如图所示:
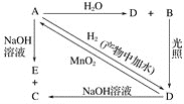
(1)请分别写出下列物质的化学式(如为溶液请填溶质的化学式):A________、B________、D________。
(2)写出下列反应的化学方程式或离子方程式(请注明反应条件):A+H2O(离子方程式):_________;A+NaOH(离子方程式):_______________;D→A(化学方程式):____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各项正确的是( )
A.钠与水反应的离子方程式:Na+H2O=Na++OH-+H2↑
B.铁与水蒸气反应的化学方程式:3Fe+4H2O(g)![]() Fe3O4+4H2
Fe3O4+4H2
C.镁、铝与沸水不可能反应
D.钠和硫酸铜溶液反应的离子方程式:2Na+Cu2+=2Na++Cu
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物H是制取某药物的中间体,实验室由芳香族化合物A制备H的一种合成路线如下:
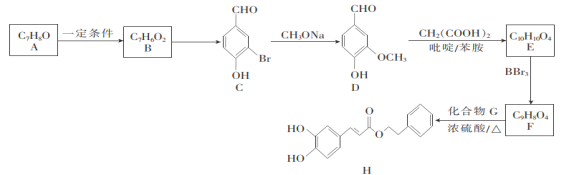
已知:Ⅰ.RCHO+CH2(COOH)2![]() RCH=CHCOOH
RCH=CHCOOH
Ⅱ. ![]()
回答下列问题:
(1)B的结构简式为____________,H的分子式为____________。
(2)C中含氧官能团的名称是____________,B→C的反应类型为____________。
(3)写出F+G→H的化学方程式:____________________________________。
(4)M是D的同分异构体,同时满足下列条件的M的结构有____________种。
①能与FeCl3溶液发生显色反应;
②能发生水解反应;
③苯环上只有两个取代基。
其中核磁共振氢谱显示有4组峰,且峰面积之比为3:2:2:1的M的结构简式为_______。
(5)写出以![]() 、CH2(COOH)2为原料合成
、CH2(COOH)2为原料合成![]() 的流程图(无机试剂任选)。
的流程图(无机试剂任选)。
_____________________________________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com