
【题目】乙醇是一种重要的化工原料,由乙醇为原料衍生出的部分化工产品如下图所示:
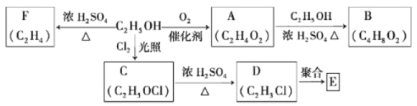
回答下列问题:
(1)A的结构简式为___________________。
(2)B的化学名称是____________________。
(3)由乙醇生产C的化学反应类型为____________________。
(4)E是一种常见的塑料,其化学名称是_________________________。
(5)由乙醇生成F的化学方程式为_______________________________。
【答案】CH3COOH 乙酸乙酯 取代反应 聚氯乙烯 CH3CH2OH![]() CH2=CH2↑+ H2O
CH2=CH2↑+ H2O
【解析】
乙醇在浓硫酸作用下加热发生消去反应生成乙烯,F是乙烯;乙醇能被氧化为乙酸,A是乙酸;乙酸、乙醇在浓硫酸催化作用下生成乙酸乙酯,B是乙酸乙酯;乙醇与C的分子式比较可知,乙醇分子中的1个H原子被取代,所以反应类型为取代反应;C在浓硫酸的作用下发生消去反应得D为CH2=CHCl,D发生加聚反应得E为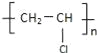 ,据此分析解答;
,据此分析解答;
(1)A是乙酸,A的结构简式为CH3COOH;
(2)B为CH3COOCH2CH3,名称是乙酸乙酯;
(3)乙醇与C的分子式比较可知,乙醇分子中的1个H原子被取代,所以反应类型为取代反应;
(4)E结构简式为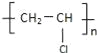 ,其化学名称是聚氯乙烯;
,其化学名称是聚氯乙烯;
(5)乙醇在浓硫酸作用下加热发生消去反应生成乙烯的方程式为CH3CH2OH ![]() CH2=CH2↑+ H2O
CH2=CH2↑+ H2O


科目:高中化学 来源: 题型:
【题目】如图所示晶体结构是一种具有优良的电压、电光等功能的晶体材料的最小结构单元(晶胞).晶体内与每个“Ti”紧邻的氧原子数和这种晶体材料的化学式分别是(各元素所带电荷均已略去)( )
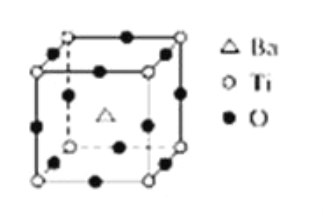
A. 8;BaTi8O12
B. 8;BaTi4O9
C. 6;BaTiO3
D. 3;BaTi2O3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一氯化硫(S2Cl2)是一种重要的有机合成氯化剂,实验室和工业上都可以用纯净干燥的氯气与二硫化碳反应来制取(CS2+3Cl2![]() CCl4+S2Cl2),其装置如下:
CCl4+S2Cl2),其装置如下:
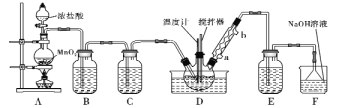
(1)A装置中的离子反应方程式为 ________________________________________________。
(2)一氯化硫(S2Cl2)常温下为液态,较为稳定,受热易分解,易被氧化,且遇水即歧化,歧化产物中不仅有淡黄色固体,而且还有两种气体,用NaOH溶液吸收该气体可得两种盐Na2SO3和NaCl。 写出一氯化硫与水反应的化学反应方程式:____________________________。
(3)C、E装置中所盛溶液为__________。
(4)D中冷凝管的冷水进水口为____(填“a”或“b”);实验过程中,需要先点燃A处酒精灯,通入氯气一段时间后方可向D中水槽里面加入热水加热,这样做的目的是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮、硫的化合物合成、应用以及对环境的影响一直是科学界研究的热点。
(1)尿素主要以NH3和CO2为原料进行合成。主要通过以下两个反应进行:
反应1:2NH3(l)+CO2(g)![]() H2NCOONH4(l) ΔH1= -117.2 kJ·mol-1
H2NCOONH4(l) ΔH1= -117.2 kJ·mol-1
反应2:H2NCOONH4(l)![]() H2O(l)+CO(NH2)2(l) ΔH2=+21.7 kJ·mol-1
H2O(l)+CO(NH2)2(l) ΔH2=+21.7 kJ·mol-1
请回答:CO(NH2)2 (l)+H2O(l)![]() 2NH3(l)+CO2(g) ΔH3=_____________,该反应能自发进行的主要原因是__________________.
2NH3(l)+CO2(g) ΔH3=_____________,该反应能自发进行的主要原因是__________________.
(2)焦炭催化还原SO2生成S2,化学方程式为:2C(s)+2SO2(g)![]() S2(g)+2CO2(g),在恒容容器中,1 mol/LSO2与足量的焦炭反应,SO2的转化率随温度的变化如图所示。
S2(g)+2CO2(g),在恒容容器中,1 mol/LSO2与足量的焦炭反应,SO2的转化率随温度的变化如图所示。
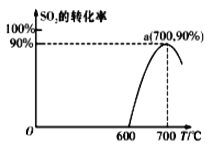
①若700℃发生该反应,经3分钟达到平衡,计算0—3分钟v(S2)=_______molL-1min-1,该温度下的平衡常数为_________.
②若该反应在起始温度为700℃的恒容绝热容器中进行,达到平衡时SO2的转化率________90%(填“>”、“<”或“=”).
③下列说法一定能说明该反应达到平衡状态的是_______.
A.焦炭的质量不再变化时
B.CO2、SO2的浓度相等时
C.SO2的消耗速率与CO2的生成速率之比为1:1
D.容器的总压强不再变化时
(3) NO2、O2和熔融KNO3可制作燃料电池,其原理如图所示.

石墨I附近发生的反应为__________________________________,当外电路通过1mole-,正极上共消耗_______mol N2O5 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铜是人类最早发现并广泛使用的一种金属。向硫酸铜溶液中逐滴滴加稀氨水,产生蓝色沉淀:继续滴加稀氨水,沉淀溶解,溶液最终变为深蓝色:再向深蓝色溶液中加入无水乙醇,析出[Cu(NH3)4]SO4·H2O。回答下列问题:
(1)基态Cu原子中,电子在核外排布的原子轨道共有________个。
(2)N、O、S元素的原子对键合电子吸引力最大的是_________。
(3)乙醇分子中C原子的杂化方式是_________
(4)[Cu(NH3)4]2+中,提供孤对电子的是________,Cu(NH3)2Cl2有两种同分异构体,其中一种可溶于水,则此种化合物是_______(填“极性”或“非极性”)分子,由此推知[Cu(NH3)4]2+的空间构型是_________。
(5)硫元素对应的含氧酸酸性是H2SO4
强于H2SO3,其原因为___________________。
(6)铜的一种氧化物晶体结构如图所示,
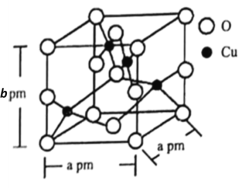
该氧化物的化学式是________。若该晶体结构为长方体,其参数如图,阿伏加德罗常数为NA,则该氧化物的密度为_______g·cm-3。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】目前世界上60%的镁是从海水中提取的,从海水中提取的MgCl2制得Mg和Cl2,进一步联合用金红石(主要成分TiO2)冶炼金属钛,工业上其主要的生产流程如下:
|
回答下列问题:
(1)加入过量试剂①后,能够分离得到Mg(OH)2沉淀的方法操作1用到的玻璃仪器有________________________________________;试剂②可以选用______。
(2)要得到MgCl2·6H2O的操作2名称是___________________________________。
(3)工业上冶炼金属钛的上述生产流程,其第1步是在高温下向金红石(主要成分TiO2)与焦炭的混合物中通入Cl2,得到TiCl4和一种可燃性气体,写出这步反应的化学方程式:____________________________。
(4) 工业上冶炼金属钛的上述生产流程,其第2步是在稀有气体氛围和加热的条件下,用镁与TiCl4反应得到钛,写出这步反应的化学方程式____________________,该反应时稀有气体氛围的作用是_____________________________________,该反应的金属冶炼方法属于是____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图所示为海水综合利用的部分流程,下列有关说法错误的是( )
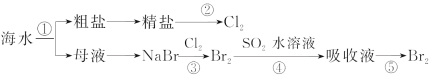
A.实验室进行①的操作需要用到坩埚、玻璃棒、酒精灯
B.②是一个将电能转化为化学能的过程
C.③④⑤涉及的反应均为氧化还原反应
D.④中反应的离子方程式为SO2+Br2+2H2O=4H++SO42-+2Br-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】姜黄素是一种天然染料,工业上可用石油的裂解产物通过如下反应制得:
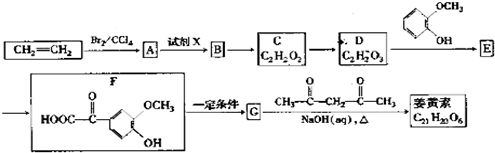
已知:①![]()
②![]()
请回答下列问题:
(1)试剂X为___________;
(2)1molE最多能消耗Na、NaOH、NaHCO3的物质的量分别为3mo1、2mol、1mol,则E的结构简式为___________;
(3)姜黄素中的含氧官能团除甲氧基(CH3O-)外还有___________(写名称).
(4)反应B→C的化学方程式为___________,其反应类型是___________;
(5)符合下列条件G的同分异构体共有___________种,其中核磁共振氢谱中有5组峰,且面积比为2:2:2:1:1的是___________;
①属于芳香酯类 ②苯环上有两个取代基 ③能与FeCl3溶液发生显色反应
(6)借鉴制取姜黄素的方法也能合成肉桂醛 (![]() ),写出制备肉桂醛所需有机物的结构简式___________
),写出制备肉桂醛所需有机物的结构简式___________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】两种金属混合物共15 g,投入足量的盐酸中,充分反应后得到11.2 L H2(标准状况),则原混合物的组成肯定不可能为 ( )
A. Mg和Ag B. Zn和Cu
C. Al和Zn D. Al和Cu
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com