
【题目】人体内最重要的供能物质是
A.葡萄糖 B.纤维素 C.油脂 D.蛋白质
科目:高中化学 来源: 题型:
【题目】向纯水中加入少量NaHSO4,在温度不变时,溶液中 ( )
A.c(H+)/c(OH-)增大 B.c(H+)减小
C.水中c(H+)与c(OH-)的乘积增大 D.c(OH-)增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式的书写正确的是 ( )
A.在硫酸铜溶液中加入过量氢氧化钡溶液Ba2++SO![]() =BaSO4↓
=BaSO4↓
B.钠与水的反应Na+2H2O=Na++2OH-+H2↑
C.氯气通入氢氧化钠溶液中2Cl2+2OH-=3Cl-+ClO-+H2O
D.大理石溶于醋酸的反应CaCO3+2CH3COOH=Ca2++2CH3COO-+CO2↑+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I. 为比较Cl2、Fe3+、SO2的氧化性,用下图所示装置进行实验,其过程如下:

①.打开弹簧夹K1~K4,通入一段时间N2,再将T型导管插入B中,继续通入N2,然后关闭K1、K3、K4。
②.打开活塞a,滴加一定量的浓盐酸,给A加热。
③.当B中的溶液变黄时,停止加热,夹紧弹簧夹K2。
④.打开活塞b,使约2mL的溶液流入D试管中,检验其中的离子。
⑤.打开弹簧夹K3、活塞c,加入70%的硫酸,一段时间后夹紧弹簧夹K3。
⑥.更新试管D,重复过程④,检验B溶液中的离子。
(1)棉花中浸润的溶液为__________。
(2)当A中足量固体加入36.5%密度为1.2g/mL盐酸100mL时,其反应转移的电子数目为______。
(3)过程⑥中检验B溶液中是否含有硫酸根离子的操作是___________。
(4)甲、乙、丙三位同学分别完成了上述实验,他们的检测结果一定能够证明氧化性的是____同学,其氧化性顺序为____________。
过程④ B溶液中含有的离子 | 过程⑥ B溶液 中含有的离子 | |
甲 | 有Fe3+无Fe2+ | 有SO42- |
乙 | 既有Fe3+又有Fe2+ | 有SO42- |
丙 | 有Fe3+无Fe2+ | 有Fe2+ |
II. NaNO2是重要的防腐剂,+3价的氮易发生氧化反应且在酸性环境中不稳定。其5mol/L水溶液pH为9。某化学兴趣小组设计如下图所示装置制备亚硝酸钠。其操作是①关闭弹簧夹,打开A中分液漏斗活塞,滴加一定量浓硝酸,加热;②一段时间后停止加热。回答下列问题:

(1)B中观察的主要现象是__________,D装置的作用是____________。
(2)检验C中产物有亚硝酸钠的操作是_______,相应反应方程式为___________。
(3)经检验C中产物亚硝酸钠含量较少。a. 甲同学认为C中产物不仅有亚硝酸钠,还有其他杂质。为排除干扰,甲在B、C装置间增加装置E,E中盛放的试剂是_______(写名称)。b. 乙同学认为除上述干扰因素外,还会有氧气参与反应导致产品不纯,所以在实验操作①前应增加一步操作,该操作是___。
(4)由题给条件计算HNO2的Ka数值为______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知钍![]() 的原子可发生下列放射性变化:
的原子可发生下列放射性变化: ![]() →
→![]() +
+ ![]()
A. X的氢氧化物是一种强碱 B. X元素位于第六周期
C. X的碳酸盐难溶于水 D. X的最高化台价为+2价
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用CO合成甲醇(CH3OH)的化学方程式为CO(g)+2H2(g)![]() CH3OH(g) ΔH<0,按照相同的物质的量投料,测得CO在不同温度下的平衡转化率与压强的关系如图所示。下列说法正确的是( )
CH3OH(g) ΔH<0,按照相同的物质的量投料,测得CO在不同温度下的平衡转化率与压强的关系如图所示。下列说法正确的是( )
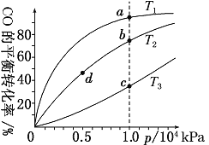
A.温度:T1>T2>T3
B.正反应速率:v(a)>v(c) v(b)>v(d)
C.平衡常数:K(a)>K(c) K(b)=K(d)
D.平均摩尔质量:M(a)<M(c) M(b)>M(d)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇是一种可再生能源,具有广泛的开发和应用前景.工业上一般采用下列反应合成甲醇CO(g)+2H2(g)CH3OH(g)△H
(1)下表所列数据是反应在不同温度下的化学平衡常数(K).
温度 | 250℃ | 300℃ | 350℃ |
K | 3.041 | 1.000 | 0.120 |
由表中数据判断△H 0(填“>”、“=”或“<”),化学平衡常数表达式K= ;
(2)300℃时,在体积为2.0L的密闭容器中通入2mol CO和4mol H2,经过20s 达到平衡状态,
①计算20s内CO的反应速率为 ,此时容器中甲醇的体积分数为 ;
②若向上述平衡体系中同时加入1mol CO,2mol H2和1mol CH3OH气体,平衡移动情况是
(填“向右”、“向左”或“不移动”),原因是 ;
(3)已知在常温常压下:
①2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g)△H1=﹣1277.0kJ/mol
②2CO(g)+O2(g)=2CO2(g)△H2=﹣566.0kJ/mol
③H2O(g)=H2O(l)△H3=﹣44kJ/mol写出甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式: ;
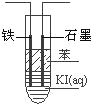
(4)甲醇,氧气可制作燃料电池,写出以氢氧化钾为电解质甲醇燃料电池负极反应式 ;如图,电解KI溶液制碘,在粗试管中加入饱和的KI溶液,然后再加入苯,插入一根石墨电极和一根铁电极,使用该燃料电池做电源,铁电极与 极(填正或负)相连接,通电一段时间后,断开电源,振荡试管,上层溶液为 色,当有1.27g 碘单质生成时,需要 g CH3OH.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com