
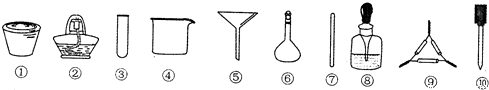
| A. | 将茶叶灼烧灰化,选用①、②和⑨ | |
| B. | 检验滤液中的Fe3+,选用③、⑧和⑩ | |
| C. | 用浓硝酸溶解茶叶灰并加蒸馏水稀释,选用④、⑥和⑦ | |
| D. | 过滤得到的滤液,选用④、⑤和⑦ |
分析 检验茶叶中的铁元素,先将茶叶在坩埚中灼烧灰化,然后在烧杯中用浓硝酸溶解茶叶灰并加蒸馏水稀释,在漏斗中过滤,可取少量滤液于小试管中,用KSCN溶液检验,以此解答该题.
解答 解:A.将茶叶灼烧灰化,应在坩埚中加热,用到的仪器有①、②和⑨,必要时还可用到三脚架或铁架台带铁圈,故A不选;
B.检验滤液中的Fe3+,可用胶头滴管取少量滤液于小试管中,用KSCN溶液检验,用到的仪器有试管、胶头滴管和滴瓶等,即③、⑧和⑩,故D不选;
C.用浓硝酸溶解茶叶灰并加蒸馏水稀释,应在烧杯中进行,可用玻璃棒搅拌,不用容量瓶,故C选;
D.过滤时用到④、⑤和⑦,故D不选;
故选C.
点评 本题考查物质的检验和鉴别的实验设计与评价,着重于考查学生的分析能力和实验能力,落脚于基础知识的考查,注意把握实验的原理、步骤和实验仪器,难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
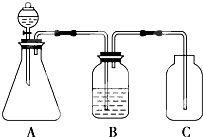
| A. | A中的化学反应可能为:CaCO3+2HCl═CO2↑+CaCl2+H2O | |
| B. | 装置B中盛放的试剂为Na2CO3溶液 | |
| C. | 装置C中盛放的为可溶性硅酸盐 | |
| D. | 由此实验可得到的结构是:酸性HCl>H2CO3>H2SiO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | c(SO42-)>c(NH4+)>c(Fe2+)>c(H+)>c(OH-) | B. | c(SO42-)=c(NH4+)>c(Fe2+)>c(H+)>c(OH-) | ||
| C. | 2c(SO42-)+c(OH-)=c(NH4+)+2c(Fe2+)+c(H+) | D. | c(NH4+)+c(NH3•H2O)=2c(Fe2+)+2c[Fe(OH)2] |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 元素 | A | B | R | D |
| 相关信息 | 基态原子核外电子占据3个能级且最高能级上有3个电子 | B的单质是最常见半导体材料 | 位于第四周期I B族 | 是非金属元素,其形成的某种单质是电的良导体,有的分子形状似足球 |
| 键能(kJ/mol) | 熔点(K) | 沸点(K) | |
| BO2 | B-O:452 | 1923 | 2503 |
| DO2 | D=O:615,D-O:348 | 216 | 195 |
 ,研究表明该离子中每个氯原子最外层均达到8电子稳定结构,有些氯与R之间存在配位键,若该长链离子中含有n个R,则该离子的化学式为$(CuC{l}_{3}{)_{n}}^{n-}$.
,研究表明该离子中每个氯原子最外层均达到8电子稳定结构,有些氯与R之间存在配位键,若该长链离子中含有n个R,则该离子的化学式为$(CuC{l}_{3}{)_{n}}^{n-}$. ( AH3配体作为一个整体写).
( AH3配体作为一个整体写).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1mol/L NaHCO3溶液与0.1mol/L NaOH溶液等体积混合,所得溶液中:c(Na+)>c(CO32-)>c(HCO3-)>c(OH-) | |
| B. | 20mL 0.1mol/L CH3COONa溶液与10mL 0.1mol/L HCl溶液混合后溶液呈酸性,所得溶液中:c(CH3COO-)>c(Cl-)>c(CH3COOH)>c(H+) | |
| C. | 室温下,pH=2的盐酸与pH=12的氨水等体积混合,所得溶液中:c(Cl-)+c(H+)>c(NH4+)+c(OH-) | |
| D. | 0.1mol/L CH3COOH溶液与0.1mol/L NaOH溶液等体积混合,所得溶液中:c(OH-)>c(H+)+c(CH3COOH) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com