
分析 ①标况下气体密度=$\frac{M}{{V}_{m}}$;N=$\frac{V}{{V}_{m}}$×NA×3;
②氨气的物质的量=$\frac{V}{{V}_{m}}$,溶液的物质的量浓度=$\frac{\frac{V}{{V}_{m}}}{V}$;
氨气的质量=$\frac{V}{{V}_{m}}M$,溶液的质量=dg/mL×VmL=dVg,溶液质量分数=$\frac{氨气质量}{溶液质量}$×100%;
③相同条件下,相同体积的不同气体其物质的量相等,
该烧瓶中氨气物质的量=$\frac{1{0}^{-3}V}{22.4}$mol,氨气的质量=$\frac{1{0}^{-3}V}{22.4}$mol×17g/mol=$\frac{17V}{22400}$g,
则相同条件下氢气的质量=$\frac{1{0}^{-3}V}{22.4}$mol×2g/mol=$\frac{V}{11200}$g,
则烧瓶质量=ag-$\frac{V}{11200}$g,
则充满氨气的质量=氨气质量+烧瓶质量.
解答 解:①标况下气体密度=$\frac{M}{{V}_{m}}$=$\frac{17g/mol}{22.4L/mol}$=0.76g/L;N=$\frac{V}{{V}_{m}}$×NA×3=$\frac{1{0}^{-3}V}{22.4}$mol×NA/mol×3=$\frac{3{N}_{A}V}{22400}$,
故答案为:0.76g/L;$\frac{3{N}_{A}V}{22400}$;
②氨气的物质的量=$\frac{V}{{V}_{m}}$=$\frac{1{0}^{-3}V}{22.4}$mol,溶液的物质的量浓度=$\frac{\frac{V}{{V}_{m}}}{V}$=$\frac{1}{{V}_{m}}$mol/L=$\frac{1}{22.4}$mol/L或0.045 mol/L;
氨气的质量=$\frac{V}{{V}_{m}}M$,溶液的质量=dg/mL×VmL=dVg,溶液质量分数=$\frac{氨气质量}{溶液质量}$×100%=$\frac{(\frac{1{0}^{-3}V}{22.4}×17)g}{dVg}×100%$=$\frac{17}{224d}%$,
故答案为:$\frac{1}{22.4}$mol/L或0.045 mol/L;$\frac{17}{224d}%$;
③相同条件下,相同体积的不同气体其物质的量相等,
该烧瓶中氨气物质的量=$\frac{1{0}^{-3}V}{22.4}$mol,氨气的质量=$\frac{1{0}^{-3}V}{22.4}$mol×17g/mol=$\frac{17V}{22400}$g,
则相同条件下氢气的质量=$\frac{1{0}^{-3}V}{22.4}$mol×2g/mol=$\frac{V}{11200}$g,
则烧瓶质量=ag-$\frac{V}{11200}$g,
则充满氨气的质量=ag-$\frac{V}{11200}$g+$\frac{17V}{22400}$g=(a+$\frac{15V}{22400}$)g,
故答案为:(a+$\frac{15V}{22400}$).
点评 本题考查物质的量浓度有关计算,为高频考点,侧重考查学生分析计算能力,把握各个物理量之间的关系是解本题关键,注意②中氨水物质的量浓度与气体体积无关,为易错点.


科目:高中化学 来源: 题型:推断题
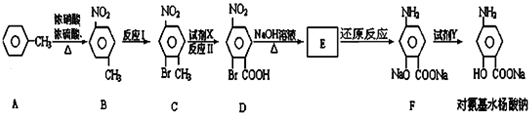
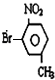 或
或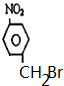 .
.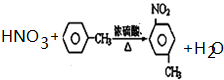 (注明反应条件).
(注明反应条件).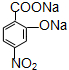 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
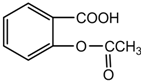 如图乙酰水杨酸又名阿斯匹林(Aspirin)具有退热、镇痛作用,常用于治疗伤风、感冒、头痛、神经痛及风湿性关节痛,近年来又用于防治老年性心血管病,但患有消化道溃疡的人不宜服用.对此化合 物不正确的说法是( )
如图乙酰水杨酸又名阿斯匹林(Aspirin)具有退热、镇痛作用,常用于治疗伤风、感冒、头痛、神经痛及风湿性关节痛,近年来又用于防治老年性心血管病,但患有消化道溃疡的人不宜服用.对此化合 物不正确的说法是( )| A. | 阿斯匹林的化学式为C9H8O4 | |
| B. | 该化合物具有酸性,能与 NaOH 或 NaHCO3反应 | |
| C. | 1 mol 该化合物与足量的 NaOH溶液反应,消耗 NaOH最大的物质的量为2 mol | |
| D. | 纯净的 Aspirin 不能与 FeCl3溶液反应,但它的水解产物能使FeCl3溶液显色 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 质子数为53、中子数为78的碘原子:${\;}_{53}^{131}$I | |
| B. | N2的电子式: | |
| C. | S2-的结构示意图: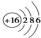 | |
| D. | 丙醛的结构简式:CH3CH2COH |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | AgNO3 和Cu(NO3)2 | B. | Cu(NO3)2和Fe(NO3)2 | C. | AgNO3 和Fe(NO3)2 | D. | Fe(NO3)2 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com