
| A. | 电解精炼铜时,粗铜作阴极 | |
| B. | 电解精炼铜时,溶液浓度基本不变 | |
| C. | 在铁制容器上镀铜时,可用CuSO4溶液作电镀液 | |
| D. | 在铁制容器上镀铜时,铁制容器连接外接电源的正极 |
分析 A、电解法精炼铜时,粗铜作阳极,纯铜作阴极;
B、电解精炼铜时,阳极是活泼电极,阴极上是铜离子失电子的氧化反应,据电极反应判断;
C、在铁制容器上镀铜时,电镀液是含有镀层金属阳离子的盐;
D、在铁制容器上镀铜时,镀层金属做阳极,镀件作阴极,电镀液是含有镀层金属阳离子的盐.
解答 解:A、电解法精炼铜时,粗铜作阳极,纯铜作阴极,故A错误;
B、电解精炼铜时,阳极是活泼电极,金属锌、铁、镍先于金属铜失电子,阴极上是铜离子失电子的氧化反应,所以溶液浓度减小,故B错误;
C、在铁制容器上镀铜时,电镀液是含有镀层金属阳离子的盐,可用CuSO4溶液作电镀液,故C正确;
D、在铁制容器上镀铜时,镀层金属做阳极,镀件作阴极,电镀液是含有镀层金属阳离子的盐,即铁制容器连接外接电源的负极,故D错误.
故选C.
点评 本题考查了电解池的工作原理,明确电极上得失电子及反应类型是解本题关键,注意电解池中活泼金属作阳极时,阳极上金属放电而不是电解质溶液中阴离子放电,为易错点.


科目:高中化学 来源: 题型:选择题
| A. | 22.4LCO和CO2的混合气体中所含的碳原子数一定是NA | |
| B. | 含1molHCl的盐酸溶液与足量Fe反应,Fe所失去的电子总数为2NA | |
| C. | 常温常压下,32gO2和32gO3所含氧原子数都是2NA | |
| D. | 1mol/L的Na2SO4溶液中含2NA个Na+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用10mL量筒量取6.8mL稀H2SO4 | |
| B. | 用碱式滴定管量取15.80mLKMnO4溶液 | |
| C. | 酸碱中和滴定时,滴定管需用标准液或待测液润洗 | |
| D. | 中和热测定时,氢氧化钠溶液稍过量的目的是为了保证盐酸完全被中和 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,22.4LNO与11.2LO2混合,混合气体所含分子数为NA | |
| B. | 1molAl3+含有的核外电子数为10NA | |
| C. | 常温常压下,1mol氮气含有的原子总数为NA | |
| D. | 1L1mol/LFeCl3溶液全部制成胶体,其中含胶粒的数目小于NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 、④-
、④- 、⑨-
、⑨- ),则该化合物的化学式为:MgCNi3(用元素符号表示).
),则该化合物的化学式为:MgCNi3(用元素符号表示).
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 无色溶液中:NH4+、Cu2+、CO32-、Cl- | |
| B. | 中性溶液中可能大量存在Na+、Ba2+、Cl-、NO3- | |
| C. | pH值为1的溶液:Na+、Al3+、CH3COO-、SO42- | |
| D. | 由水电离的c(H+)=1×10-13mol•L-1的溶液中:Mg2+、K+、HCO3-、Br- |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
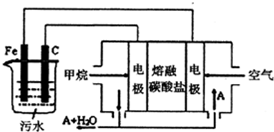 电浮选凝聚法是工业上采用的一种污水处理方法,通过电解污水最终生成的Fe(OH)3吸附污物而沉积下来,达到净水的目的.阴极产生的气泡把污水中悬浮物带到水面形成浮渣层,除去浮渣层,即起到了浮选净化的作用,某科研小组利用上述原理,设计出如图所示的装置.
电浮选凝聚法是工业上采用的一种污水处理方法,通过电解污水最终生成的Fe(OH)3吸附污物而沉积下来,达到净水的目的.阴极产生的气泡把污水中悬浮物带到水面形成浮渣层,除去浮渣层,即起到了浮选净化的作用,某科研小组利用上述原理,设计出如图所示的装置.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验操作 | 实验现象 | 结论 |
| A | 向KI溶液中加入CCl4,振荡后静置 | 液体分层,下层呈紫红色 | 碘易溶于CCl4,难溶于水 |
| B | 向Fe(NO3)2样品溶于稀H2SO4 | 溶液不变红 | 稀硫酸不能氧化Fe2+ |
| C | 将SO2通入Ba(N03)2溶液中 | 无明显现象 | SO2与Ba(NO3)2不反应 |
| D | 葡萄糖溶液与新制Cu(OH)2混合加热 | 生成砖红色沉淀 | 葡萄糖分子中含有醛基 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com