
今有:①纯净的碳酸钠ag;②碳酸钠与碳酸氢钠的混合物ag.两者相比,下列各种情况的描述正确的是()
| A. | 分别和盐酸完全反应时,混合物的耗酸量多 | |
| B. | 分别和盐酸完全反应时,纯净的碳酸钠放出的CO2多 | |
| C. | 分别溶于水,再加入足量澄清石灰水,混合物得到的沉淀质量大 | |
| D. | 分别配成等体积的溶液,混合物溶液的Na+的物质的量浓度大 |
| 钠的重要化合物. | |
| 专题: | 元素及其化合物. |
| 分析: | 碳酸钠和碳酸氢钠分别与盐酸发生:CO32﹣+2H+=CO2↑+H2O,HCO3﹣+H+=CO2↑+H2O,可根据反应的离子方程式判断消耗的盐酸以及生成的二氧化碳的量的关系,碳酸钠与碳酸氢钠都可与澄清石灰水反应生成沉淀,以此解答该题. |
| 解答: | 解:碳酸钠和碳酸氢钠分别与盐酸发生:CO32﹣+2H+=CO2↑+H2O,HCO3﹣+H+=CO2↑+H2O,等质量时,碳酸钠消耗盐酸的物质的量为mol,如全部为碳酸氢钠,消耗盐酸的物质的量为mol,则 A.分别和盐酸反应时,ag纯净的碳酸钠消耗盐酸的物质的量为mol,ag碳酸钠与碳酸氢钠的混合物消耗盐酸的物质的量为mol~mol之间,则碳酸钠消耗的盐酸多,故A错误; B.分别和足量盐酸反应时,ag纯净的碳酸钠生成二氧化碳的物质的量为mol,ag碳酸钠与碳酸氢钠的混合物生成二氧化碳的物质的量介于mol~mol之间,则混合物放出的CO2多,故B错误; C.分别溶于水,再加入足量澄清石灰水,都可生成碳酸钙沉淀,ag纯净的碳酸钠生成碳酸钙的物质的量为mol,ag碳酸钠与碳酸氢钠的混合物生成碳酸钙的物质的量介于mol~mol之间,混合物得到的沉淀质量大,故C正确; D.碳酸钠含有Na+的物质的量为mol,ag碳酸钠与碳酸氢钠的混合物含有Na+的物质的量为mol~mol之间,则分别配成等体积的溶液,碳酸钠溶液的Na+的物质的量浓度大,故D错误. 故选C. |
| 点评: | 本题考查混合物的计算,为高频考点,侧重于学生的分析能力和计算能力的考查,题目难度中等,注意根据反应的相关方程式计算. |


科目:高中化学 来源: 题型:
下列关于化学键的叙述,正确的一项是( )
A.离子化合物中一定含有离子键
B.单质分子中均不存在化学键
C.非金属元素组成的化合物中只含共价键
D.含有共价键的化合物一定是共价化合
查看答案和解析>>
科目:高中化学 来源: 题型:
关于溶液的酸碱性说法正确的是 ( )
A. C(H+)很小的溶液一定呈碱性 B. PH=7的溶液一定呈中性
C. C(OH-)= C(H+)的溶液一定呈中性 D. 不能使酚酞试液变红的溶液一定呈酸性
查看答案和解析>>
科目:高中化学 来源: 题型:
在含有弱电解质的溶液中,往往有多个化学平衡共存。
(1)常温下,将0.2mol/L的某一元酸HA溶液和0.1mol/L NaOH溶液等体积混合后溶液pH大于7,若混合液体积等于两溶液体积之和,则混合液中下列关系正确的是
A.c(HA)<c(A-) B.c(HA)一定大于0.1mol/L
C.c(Na+)=c(HA)+c(A-) D.2c(OH-)=2c(H+)+[c(HA)-c(A-)]
(2)常温下在20mL0.1mol/L Na2CO3溶液中逐滴加入0.1mol/L HCl溶液40mL,溶液中含碳元素的各种微粒(CO2因逸出未画出)物质的量分数(纵轴)随溶液pH变化的部分情况如下图所示。回答下列问题:
①在同一溶液中,H2CO3、HCO3-、 CO32-(填:“能”或“不能”) 大量共存。
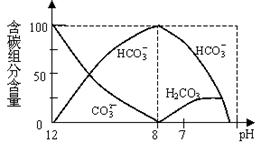 ②当pH=7时,溶液中各种离子其物质的量浓度之间的等量关系是: 。
②当pH=7时,溶液中各种离子其物质的量浓度之间的等量关系是: 。
③已知在25℃时,CO32-水解反应的平衡常数即水解常数Kh

 2×10-4,当溶液中c(HCO3-)︰c(CO32-)
2×10-4,当溶液中c(HCO3-)︰c(CO32-) 2︰1时,溶液的pH
2︰1时,溶液的pH 。
。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列叙述正确的是()
| A. | Na2O与Na2O2都能和水反应生成碱,它们是碱性氧化物 | |
| B. | Na2CO3溶液和NaHCO3溶液都能跟CaCl2溶液反应得到白色沉淀 | |
| C. | Na2O2应保存于密封、干燥带玻璃塞的广口瓶中 | |
| D. | Na2O2可作供氧剂,而Na2O不行 |
查看答案和解析>>
科目:高中化学 来源: 题型:
用1L 1.0mol•L﹣1 NaOH溶液吸收0.8mol CO2,所得溶液中的CO32﹣和HCO3﹣的浓度之比约是()
| A. | 1:3 | B. | 1:2 | C. | 2:3 | D. | 3:2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
下表是元素周期表的一部分,请针对表中所列标号为①~⑩的元素回答下列问题。
|
 | IA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 | ||||
| 二 | ① | ② | ③ | ④ | ||||||||
| 三 | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | ⑩ |
(1)非金属性最强的元素是______(填元素符号,下同),形成化合物种类最多的元素是_______。
(2)第三周期元素除⑩外原子半径最小的是______(填元素符号),这些元素的最高价氧化物对应水化物中碱性最强的是__________(填化学式,下同),具有两性的是____________。
(3)⑤⑥⑦单质的活泼性顺序为______>______>______ (填元素符号),判断的实验依据是________________________________________________ (写出一种)。
查看答案和解析>>
科目:高中化学 来源: 题型:
我国海水资源丰富,海水中主要含有Na+、K+、Ca2+、Mg2+、Cl-、SO42-、Br-、CO32-、HCO3—等离子。合理利用海水资源和保护环境是我国可持续发展的重要保证。
Ⅰ.火力发电燃煤排放的SO2会造成一系列环境和生态问题。利用海水脱硫是一种有效的方法,其工艺流程如下图所示:
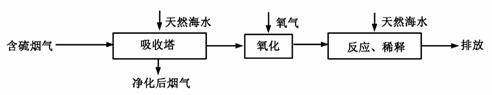
⑴天然海水的pH≈8,呈弱碱性。用离子方程式解释原因 。
⑵天然海水吸收了含硫烟气后,要用O2进行氧化处理,其反应的化学方程式是 ;氧化后的“海水”需要用大量的天然海水与之混合后才能排放,该操作的主要目的是 。
Ⅱ.重金属离子对河流及海洋造成严重污染。某化工厂废水(pH=2.0,ρ≈1g·mL-1)中含有Ag+、Pb2+等重金属离子,其浓度各约为0.01mol·L-1。排放前拟用沉淀法除去这两种离子,查找有关数据如下:
| 难溶电解质 | AgI | AgOH | Ag2S | PbI2 | Pb(OH)2 | PbS |
| KSP | 8.3×10-17 | 5.6×10-8 | 6.3×10-50 | 7.1×10-9 | 1.2×10-15 | 3.4×10-28 |
⑶你认为往废水中投入 (填字母序号),沉淀效果最好。
A. NaOH B. Na2S C. KI D. Ca(OH)2
⑷如果用生石灰处理上述废水,使溶液的pH=8.0,处理后的废水中c(Pb2+)= 。
⑸如果用食盐处理其只含Ag+的废水,测得处理后的废水中NaCl的质量分数为0.117%。若环境要求排放标准为c(Ag+)低于1.0×10-8mol·L-1,问该工厂处理后的废水中c(Ag+)= ,是否符合排放标准 (填“是”或“否”)。(已知KSP(AgCl)=1.8×10-10mol2·L-2)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com