
下列物质的检验,其结论一定正确的是( )
A.某溶液中加入BaCl2溶液,产生白色沉淀,加入HNO3后,白色沉淀不溶解,也无其他
现象,说明该溶液中一定含有SO
B.某溶液中加盐酸产生无色气体,该气体能使澄清的石灰水变浑浊,说明该溶液中一
定含有 CO 或 HCO
或 HCO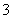
C.某溶液中加盐酸产生刺激性气味的无色气体,该气体能使品红溶液褪色,说明该溶
液中一定含有SO
D.取少量久置的Na2SO3样品于试管中加水溶解,再加入足量盐酸有气体产生,然后加入BaCl2溶液有白色沉淀产生,说明Na2SO3样品已部分被氧化
 53天天练系列答案
53天天练系列答案科目:高中化学 来源: 题型:
右图为直流电源电解稀Na2SO4溶液的装置。通电一段时间后,在石墨电极a和b附近分别滴加一滴酚酞溶液。则下列有关说法中正确的是( )
A.a电极产生H2
B.两极产生的气体均有刺激性气味
C.通电一段时间后,稀Na2SO4溶液酸性增强
D.a电极附近呈无色,b电极附近呈红色
查看答案和解析>>
科目:高中化学 来源: 题型:
下列依据热化学方程式得出的结论正确的是
A.已知C(石墨, s)=C(金刚石, s) ΔH>0,则金刚石比石墨稳定
B.已知C(s)+O2(g)=CO2(g) ΔH1 ;C(s)+1/2O2(g)=CO(g) ΔH2,则ΔH2>ΔH1
C.已知2H2(g)+O2(g)=2H2O(g) ΔH= -483.6 kJ/mol,则氢气的燃烧热为241.8kJ/mol
D.已知NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l) ΔH=-57.3kJ/mol,则含20gNaOH的稀溶液与稀盐酸完全中和,中和热为28.65kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
已知H2A在水中存在以下平衡:H2A H++HA-,HA-
H++HA-,HA- H++A2-。回答以下问题:
H++A2-。回答以下问题:
(1)已知常温下,H2A的钙盐(CaA)饱和溶液中存在平衡:
CaA(s) Ca2+(aq)+A2-(aq) ΔH > 0。
Ca2+(aq)+A2-(aq) ΔH > 0。
①温度升高时,Ksp________(填“增大”、“减小”或“不变”下同)。
②滴加少量浓盐酸,c (Ca2+)________,原因是____ ______________(用文字和离子方程式说明)。
(2)若向CaA悬浊液中加入CuSO4溶液,生成一种黑色固体物质,写出该过程中反应的离子方程式______________________。若某CuSO4溶液中c (Cu2+)=0.02 mol/L,如果要生成Cu(OH)2沉淀,应调整溶液pH,使之大于________(已知Ksp[Cu(OH)2]=2.0×10-20)。
(3)常温下,向某纯碱溶液中滴入酚酞,溶液呈红色,则该溶液呈________性。在分析该溶液遇酚酞呈红色的原因时,甲同学认为是配制溶液时所用的纯碱样品中混有NaOH所致;乙同学认为是溶液中电离出的CO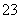 水解所致,请你设计一个简单的实验方案给甲和乙两位同学的说法进行评判(包括简要操作、现象和结论)_________________ ___________。
水解所致,请你设计一个简单的实验方案给甲和乙两位同学的说法进行评判(包括简要操作、现象和结论)_________________ ___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列化学实验事实及其结论都正确的是( )。
| 选项 | 实验事实 | 结论 |
| A | 将SO2通入含HClO的溶液中生成H2SO4 | HClO的酸性比H2SO4强 |
| B | 铝箔在酒精灯火焰上加热熔化但不滴落 | 铝箔表面氧化铝熔点高于铝 |
| C | SiO2可以和NaOH溶液及HF溶液反应 | SiO2属于两性氧化物 |
| D | 将SO2通入溴水中,溴水褪色 | SO2具有漂白性 |
查看答案和解析>>
科目:高中化学 来源: 题型:
已知离子方程式:As2S3+H2O+NO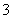 —→AsO
—→AsO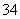 +SO
+SO +NO↑+________
+NO↑+________  (未配平),(已知:As2S3 中As的化合价为+3)则下列说法错误的是( )
(未配平),(已知:As2S3 中As的化合价为+3)则下列说法错误的是( )
A.配平后水的化学计量数为4 B.反应后溶液呈酸性
C.配平后氧化剂与还原剂的物质的量之比为3∶28 D.氧化产物为AsO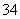 和SO
和SO
查看答案和解析>>
科目:高中化学 来源: 题型:
实验研究发现,硝酸发生氧化还原反应时,硝酸的浓度越稀,对应还原产物中氮元素的化合价越低。现有一定量铝粉和铁粉的混合物与一定体积某浓度的稀硝酸充分反应,反应过程中无气体放出(已知硝酸的还原产物是NH4NO3)。在反应结束后的溶液中,逐滴加入5mol·L-1的NaOH溶液,所加NaOH溶液的体积(mL)与产生的沉淀的物质的量关系如下图所示。则
(1)B与A的差值为: mol
(2)原硝酸溶液中含硝酸的物质的量为: mol。
(3)铝粉和铁粉的混合物中铝粉与铁粉的物质的量之比为:
(4)写出铝与该浓度硝酸反应的离子方程式:
查看答案和解析>>
科目:高中化学 来源: 题型:
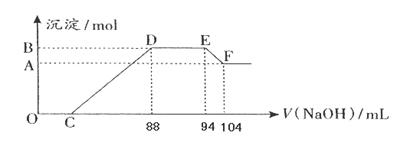
以氨气代替氢气研发氨燃料电池是当前科研的一个热点。
 (1)氨燃料电池使用的电解质溶液是2 mol·L-1的KOH溶液,电池反应为:4NH3+3O2 =2N2+6H2O。该电池负极的电极反应式为 ;每消耗1.7g NH3转移的电子数目为 。
(1)氨燃料电池使用的电解质溶液是2 mol·L-1的KOH溶液,电池反应为:4NH3+3O2 =2N2+6H2O。该电池负极的电极反应式为 ;每消耗1.7g NH3转移的电子数目为 。
(2)用氨燃料电池电解CuSO4溶液,如右图所示,A、B均为铂电极,通电一段时间后,在A电极上有红色固体析出,则B电极上发生的电极反应式为 ;此时向所得溶液中加入8gCuO固体后恰好可使溶液恢复到电解前的浓度,则电解过程中收集到的气体在标准状况下体积为 L。
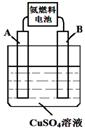
(3) 纳米级氧化亚铜(Cu2O)是一种重要光电材料。现用铜棒和石墨做电极,饱和食盐水做电解质制备纳米级氧化亚铜(Cu2O),电解反应为 。
。
铜棒上发生的电极反应式为
查看答案和解析>>
科目:高中化学 来源: 题型:
A、B、D、E、F为短周期元素,非金属元素A最外层电子数与其周期数相同,B的最外层电子数是其所在周期数的2倍。B在D中充分燃烧能生成其最高价化合物BD2。E+与D2-具有相同的电子数。A在F中燃烧,产物溶于水得到一种强酸。回答下列问题:
(1)A在周期表中的位置是________,写出一种工业制备单质F的离子方程式:
__________________________。
(2)B、D、E组成的一种盐中,E的质量分数为43%,其俗名为__________,其水溶液与F单质反应的化学方程式为____________________________________________;在产物中加入少量KI,反应后加入CCl4并振荡,有机层显______色。
(3)由这些元素组成的物质,其组成和结构信息如下表:
| 物质 | 组成和结构信息 |
| a | 含有A的二元离子化合物 |
| b | 含有非极性共价键的二元离子化合物,且原子数之比为1∶1 |
| c | 化学组成为BDF2 |
| d | 只存在一种类型作用力且可导电的单质晶体 |
a的化学式为________;b的化学式为______________;c的电子式为________;d的晶体类型是________。
(4)由A和B、D元素组成的两种二元化合物形成一类新能源物质。一种化合物分子通过________键构成 具有空腔的固体;另一种化合物(沼气的主要成分)分子进入该空腔,其分子的空间结构为__________。
具有空腔的固体;另一种化合物(沼气的主要成分)分子进入该空腔,其分子的空间结构为__________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com