
| A. | N2: | B. | NH3 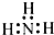 | C. | H2O H+[:O:]2-H+ | D. | NaCl  |
分析 A.氮气分子中存在氮氮三键,每个氮原子还含有1对孤对电子对;
B.氨气分子的氮原子中含有1对孤电子对;
C.水是共价化合物,原子间通过共用电子对形成化学键;
D.氯化钠为离子化合物,电子式中需要标出阴阳离子所带电荷;
解答 解:A.氮气分子中存在氮氮三键,氮原子最外层达到8电子稳定结构,每个氮原子还含有1对孤对电子对,所以氮气正确的电子式为 ,故A错误;
,故A错误;
B.氨气分子的氮原子中含有1对孤电子对,氨气分子的电子式为: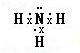 ,故B错误;
,故B错误;
C.水是共价化合物,原子间通过共用电子对形成化学键,其电子式为 ,故C错误;
,故C错误;
D.氯化钠属于离子化合物,电子式中钠离子形成离子符号形式,氯离子需要标出最外层电子,即氯化钠的电子式为 ,故D正确;
,故D正确;
故选D.
点评 本题考查了电子式的判断,该题是高考中的常见题型与重要的考点,该题基础性强,难易适中,主要是考查学生对常见化学用语的熟悉掌握程度,注意掌握电子式的概念及正确的表示方法.


 通城学典默写能手系列答案
通城学典默写能手系列答案科目:高中化学 来源: 题型:选择题
| A. | 钠在空气中燃烧生成白色的氧化钠固体 | |
| B. | 检验FeCl2溶液中的少量Fe3+,可以用KSCN溶液 | |
| C. | 二氧化硫的水溶液能使紫色石蕊溶液变红,随后使之褪色 | |
| D. | 普通玻璃的组成可用Na2O•CaO•6SiO2表示,是纯净物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 根据反应Cu+H2SO4$\frac{\underline{\;电解\;}}{\;}$CuSO4+H2↑可推出Cu的还原性比H2的强 | |
| B. | 因Cl2的氧化性强于I2的氧化性,所以置换反应I2+2NaClO3═2NaIO3+Cl2不能发生 | |
| C. | 用硫酸酸化的H2O2溶液滴入Fe(NO3)2溶液中,溶液变黄色,证明氧化性:H2O2比Fe3+强 | |
| D. | 在2Na+2C+2NH3=2NaCN+3H2↑反应中的还原剂为C和Na |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
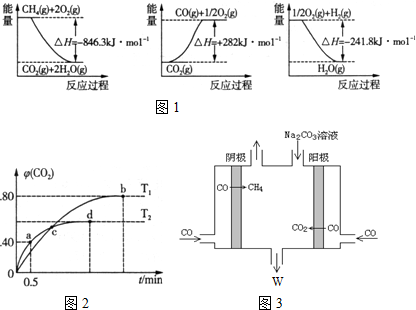
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 氢氧化物 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 | Cu(OH)2 | Zn(OH)2 |
| 开始沉淀的pH | 3.3 | 1.5 | 6.5 | 4.2[ | 5.4 |
| 沉淀完全的pH | 5.2 | 3.7 | 9.7 | 6.7 | 8.0 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
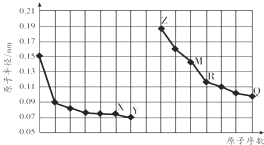
| A. | R在周期表的第15列 | |
| B. | 元素Y气态氢化物的沸点小于元素Q气态氢化物的沸点 | |
| C. | 简单离子的半径:X>Z>M | |
| D. | Z的单质能从M与Q元素构成的盐溶液中置换出单质M |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 含有极性键的分子一定是极性分子 | |
| B. | 键能越大,表示该分子越容易受热分解 | |
| C. | 在分子中,两个成键的原子间的距离叫做键长 | |
| D. | H-Cl的键能为431.8KJ/mol,H-I的键能为298.7 KJ/mol,这可以说明HCl比HI分子稳定 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| Fe3+ | Al3+ | Fe2+ | Mg2+ | |
| 开始沉淀时 | 1.5 | 3.3 | 6.5 | 9.4 |
| 沉淀完全时 | 3.7 | 5.2 | 9.7 | 12.4 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com