
”¾ĢāÄæ”æµē×Ó¹¤ŅµŹĒ¹śĆń¾¼ĆÖ§Öł²śŅµÖ®Ņ»£¬Ņ²ŹĒŠĀŠĖæĘѧ¼¼Źõ·¢Õ¹²śŅµ£®Ōų¾µē×Ó¹¤Ņµ³£ÓĆÖŹĮæ·ÖŹżĪŖ30%µÄFeCl3ČÜŅŗøÆŹ“·óÓŠĶ²µÄ¾ųŌµ°å£¬ÖĘ³ÉÓ”Ė¢ĻßĀ·°å£¬·¢Éś·“Ó¦µÄ»Æѧ·½³ĢŹ½ĪŖ£ŗ2FeCl3+CuØT2FeCl2+CuCl2 £®
£Ø1£©¼ģŃéøÆŹ“ŗóµÄČÜŅŗÖŠŹĒ·ńŗ¬ÓŠFe3+ £¬ ӦєÓƵďŌ¼ĮŹĒ £®
£Ø2£©ĪŖĮĖ“ÓŹ¹ÓĆ¹żµÄøÆŹ“·ĻŅŗÖŠ»ŲŹÕĶ£¬²¢ÖŲŠĀÖĘµĆ“æ¾»µÄFeCl3ČÜŅŗ£¬²ÉÓĆČēĶ¼ĖłŹ¾ŹµŃé²½Öč£®ĒėŌŚø÷æÕøńÄŚĢīÉĻŹŹµ±µÄ»ÆѧŹ½ŅŌŹ¹ŹµŃé“ļµ½Ō¤ĘŚÄæµÄ£®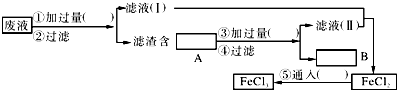
£Ø3£©Š“³öÓŠ¹Ų»Æѧ·“Ó¦µÄĄė×Ó·½³ĢŹ½£ŗ £®
”¾“š°ø”æ
£Ø1£©KSCNČÜŅŗ
£Ø2£©¢ŁĪŖFe|¢ŪĪŖŃĪĖį|¢ŻĪŖCl2|AĪŖFe”¢Cu£¬BĪŖCu
£Ø3£©2Fe3++FeØT3Fe2+ £¬ Fe+Cu2+ØTFe2++Cu£¬Fe+2H+ØTFe2++H2”ü£¬2Fe2++Cl2ØT2Fe3++2Cl©
”¾½āĪö”æ½ā£ŗ£Ø1£©¼ģŃéøÆŹ“ŗóµÄČÜŅŗÖŠŹĒ·ńŗ¬ÓŠFe3+ £¬ ӦєÓƵďŌ¼ĮŹĒKSCNČÜŅŗ£¬ĖłŅŌ“š°øŹĒ£ŗKSCNČÜŅŗ£»£Ø2£©CuCl2”¢FeCl3ÓėĢś·Ū·“Ӧɜ³ÉFe2+”¢Cu£¬ĀĖŅŗIÖŠŗ¬ĀČ»ÆŃĒĢś£¬ĀĖŌüÖŠAŗ¬ÓŠFeŗĶCu£¬³żČ„ĘäÖŠµÄFeŃ”ÓĆ¢ŪĪŖ×ćĮæŃĪĖį£¬¹żĀĖµĆµ½ĀĖŅŗIIÖŠŗ¬ĀČ»ÆŃĒĢś”¢HCl£¬BĪŖCu£¬ĻņĀČ»ÆŃĒĢśČÜŅŗÖŠĶØČė¢ŻĀČĘųÉś³ÉĀČ»ÆĢś£¬Ōņ¢ŁĪŖFe£¬¢ŪĪŖŃĪĖį£¬¢ŻĪŖCl2 £¬ AĪŖFe”¢Cu£¬BĪŖCu£¬ĖłŅŌ“š°øŹĒ£ŗ¢ŁĪŖFe£»¢ŪĪŖŃĪĖį£»¢ŻĪŖCl2£»AĪŖFe”¢Cu£»BĪŖCu£»£Ø3£©ÓŠ¹Ų»Æѧ·“Ó¦µÄĄė×Ó·½³ĢŹ½ĪŖ2Fe3++FeØT3Fe2+ £¬ Fe+Cu2+ØTFe2++Cu£¬Fe+2H+ØTFe2++H2”ü£¬2Fe2++Cl2ØT2Fe3++2Cl© £¬ ĖłŅŌ“š°øŹĒ£ŗ2Fe3++FeØT3Fe2+ £¬ Fe+Cu2+ØTFe2++Cu£¬Fe+2H+ØTFe2++H2”ü£¬2Fe2++Cl2ØT2Fe3++2Cl



| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æÓŠĻĀĮŠĪļÖŹ£ŗ¢ŁµāĖ®£»¢ŚŅų°±ČÜŅŗ£»¢ŪNaOHČÜŅŗ£»¢ÜĻ”ĮņĖį£»¢ŻÅØĮņĖį”£ŌŚ½ųŠŠµķ·ŪµÄĖ®½āŹµŃé(°üĄØ¼ģŃéĖ®½ā²śĪļ¼°Ė®½āŹĒ·ńĶźČ«)Ź±£¬³żµķ·ŪĶā£¬»¹ŠčŹ¹ÓĆÉĻŹöŹŌ¼Į»ņĘäÖŠŅ»²æ·Ö£¬ÅŠ¶ĻŹ¹ÓƵďŌ¼Į¼°ĘäĻČŗóĖ³ŠņĪŖ( )
A.¢Ü¢Ł¢Ū¢Ś
B.¢Ł¢Ü¢Ś¢Ū
C.¢Ż¢Ł¢Ū¢Ś
D.¢Ł¢Ż¢Ś¢Ū
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æŅŃÖŖ·“Ó¦N2O4(g) ![]() 2NO2(g) ”÷H>0£¬Ę½ŗāĢåĻµÖŠ×ÜÖŹĮæ
2NO2(g) ”÷H>0£¬Ę½ŗāĢåĻµÖŠ×ÜÖŹĮæ![]() Óė×ÜĪļÖŹµÄĮæ
Óė×ÜĪļÖŹµÄĮæ![]() Ö®±ČM£ØM=
Ö®±ČM£ØM=![]() /
/![]() £©ŌŚ²»Ķ¬ĪĀ¶ČĻĀĖęŃ¹Ēæ±ä»ÆĒśĻßČēĶ¼ĖłŹ¾”£ĻĀĮŠĖµ·ØÕżČ·µÄŹĒ£ŗ
£©ŌŚ²»Ķ¬ĪĀ¶ČĻĀĖęŃ¹Ēæ±ä»ÆĒśĻßČēĶ¼ĖłŹ¾”£ĻĀĮŠĖµ·ØÕżČ·µÄŹĒ£ŗ
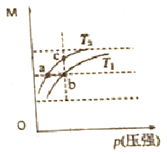
A. ĪĀ¶Č£ŗT1 £¼T2
B. Ę½ŗā³£ŹżK(a)=K(b)<K(c)
C. ·“Ó¦ĖŁĀŹ£ŗ ![]()
D. µ±M=69g”¤mol-1 Ź±£¬n(NO2)£ŗn(N2O4)=1£ŗ1
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æ±½ŌŚ“߻ƼĮ“ęŌŚĻĀÓėŅŗäå·“Ó¦£¬¶ų±½·ÓÓėäåĖ®·“Ó¦²»ÓĆ¼ÓČČŅ²²»ŠčŅŖ“߻ƼĮ£¬ŌŅņŹĒ(””””)
A.±½»·ÓėōĒ»łĻą»„Ó°Ļģ£¬µ«±½»·ÉĻµÄĒāŌ×Ó»īĘĆŠŌ²»±ä
B.±½»·ÓėōĒ»łĻą»„Ó°Ļģ£¬µ«ōĒ»łÉĻµÄĒāŌ×Ó±ä»īĘĆ
C.ōĒ»łÓ°ĻģĮĖ±½»·£¬Ź¹±½»·ÉĻµÄĒāŌ×Ó±äµĆ»īĘĆ
D.±½»·Ó°ĻģōĒ»ł£¬Ź¹ōĒ»ł±ä»īĘĆ
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æIijĪĀ¶ČĻĀ£¬Kw=10©12 £®
£Ø1£©Čō±£³ÖĪĀ¶Č²»±ä£¬ĻņÉŁĮæĖ®ÖŠ¼ÓČėgµÄNaOH¹ĢĢ壬²¢¼ÓĖ®ÖĮ1L£¬²ÅÄÜŹ¹ČÜŅŗÖŠµēĄė²śÉśµÄH+”¢OH©µÄÅØ¶Č³Ė»ż¼“£ŗc£ØH+£©c£ØOH©£©=10©22
£Ø2£©Čō±£³ÖĪĀ¶Č²»±ä£¬Ä³ČÜŅŗÖŠc£ØH+£©ĪŖ1”Į10©7mol/L£¬ŌņøĆČÜŅŗĻŌŠŌ£ØŃ”Ģī”°Ėį”±”¢”°¼ī”±»ņ”°ÖŠ”±£©
£Ø3£©ŅŃÖŖ³£ĪĀĻĀKw[Fe£ØOH£©3]=4.0”Į10©38 £¬ ŌŚFeCl3ČÜŅŗÖŠ¼ÓČėNaHCO3ČÜŅŗ£¬·¢Éś·“Ó¦µÄĄė×Ó·½³ĢŹ½ĪŖ £® ČōĖłµĆŠü×ĒŅŗµÄpHµ÷ÕūĪŖ4£¬ŌņČÜŅŗÖŠFe3+µÄÅضČĪŖmol/L£®
£Ø4£©ŹŌĄūÓĆĘ½ŗāŅʶÆŌĄķ½āŹĶĻĀĮŠŹĀŹµ£ŗ
FeS²»ČÜÓŚĖ®£¬µ«ÄÜČÜÓŚĻ”ŃĪĖįÖŠ £®
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æĀČĖįŹĒŅ»ÖÖĒæĖį£¬ĀČĖįµÄÅØ¶Č³¬¹ż40%¾Ķ»įŃøĖŁ·Ö½ā£¬·“Ó¦µÄ»Æѧ·½³ĢŹ½ĪŖ£ŗ8HClO3ØT3O2”ü+2Cl2”ü+4HClO4+2H2O£®øł¾ŻĢāŅāĶź³ÉĻĀĮŠŠ”Ģā£ŗ
¢ŁŌŚÉĻŹö±ä»Æ¹ż³ĢÖŠ£¬·¢Éś»¹Ō·“Ó¦µÄ¹ż³ĢŹĒ”ś£ØĢī»ÆѧŹ½£©£®
¢ŚøĆ·“Ó¦µÄŃõ»Æ²śĪļŹĒ£ØĢī»ÆѧŹ½£©£»ĒóĖłµĆ»ģŗĻĘųĢåµÄĘ½¾łĻą¶Ō·Ö×ÓÖŹĮæ £®
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æ°¢·ü¼ÓµĀĀŽ³£ŹżŌ¼ĪŖ6.02”Į1023 mol©1£ØNA£©£¬ĻĀĮŠĖµ·ØÕżČ·µÄŹĒ£Ø £©
A.³£ĪĀ³£Ń¹ĻĀ£¬16g O2Óė16g O3Ėłŗ¬µÄŌ×ÓŹż¾łŹĒNA
B.ĪļÖŹµÄĮæÅضČĪŖ0.5mol/LµÄMgCl2ČÜŅŗÖŠ£¬ŗ¬ÓŠCl©øöŹżĪŖ NA
C.±ź×¼×“æöĻĀ£¬2.24LCCl4Ėłŗ¬Ō×ÓŹżĪŖ0.5NA
D.±ź×¼×“æöĻĀ£¬22.4 Lŗ¤ĘųĖłŗ¬ÓŠµÄÖŹ×ÓŹżÄæŌ¼ĪŖ4”Į6.02”Į1023
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æČēĶ¼ĪŖ½ĢæĘŹéÖŠµē½ā±„ŗĶŹ³ŃĪĖ®µÄŹµŃé×°ÖĆ£®¾Ż“Ė£¬ĻĀĮŠŠšŹö²»ÕżČ·µÄŹĒ£Ø £© 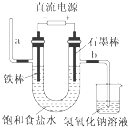
A.×°ÖĆÖŠ£¬a¹ÜÄܲśÉśĒāĘų
B.ŌŚŹÆÄ«°ōµē¼«ĒųÓņÓŠNaOH²śĪļ
C.b¹Üµ¼³öµÄŹĒĀČĘų
D.ŅŌŹ³ŃĪĖ®ĪŖ»ł“”ŌĮĻÖĘČ”ĀČĘųµČ²śĘ·µÄ¹¤Ņµ³ĘĪŖ”°ĀČ¼ī¹¤Ņµ”±
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æŅŃÖŖ£ŗ
2H2£Øg£©+O2£Øg£©ØT2H2O£Øl£©”÷H=©571.6kJmol©1£»
CH4£Øg£©+2O2£Øg£©ØTCO2£Øg£©+2H2O£Øl£©”÷H=©890kJmol©1 £®
ĻÖÓŠH2ÓėCH4µÄ»ģŗĻĘųĢå112L£Ø±ź×¼×“æö£©£¬Ź¹ĘäĶźČ«Č¼ÉÕÉś³ÉCO2ŗĶH2O£Øl£©£¬ČōŹµŃé²āµĆ·“Ó¦·ÅČČ3695kJ£¬ŌņŌ»ģŗĻĘųĢåÖŠH2ÓėCH4µÄĪļÖŹµÄĮæÖ®±ČŹĒ£Ø £©
A.1£ŗ1
B.1£ŗ3
C.1£ŗ4
D.2£ŗ3
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com