
| 催化剂 |
| 加热 |
| 催化剂 |
| 加热 |
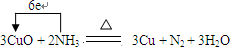 ,故答案为:
,故答案为: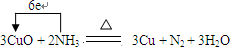 ;
;

科目:高中化学 来源: 题型:
| A、氯化铜溶液与铁粉反应:Cu2++Fe=Fe2++Cu |
| B、稀硫酸与铁粉反应:2Fe+6H+=2Fe3++3H2↑ |
| C、碳酸钙与盐酸反应:2H++CO32-=H2O+CO2↑ |
| D、氢氧化钡溶液与稀硫酸反应:Ba2++SO42-=BaSO4↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①②③④⑥ | B、②③④⑤⑥ |
| C、①②③⑤⑥ | D、全部 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
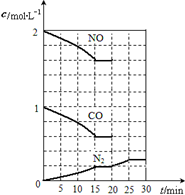 在铂-铑“三效”催化剂作用下,以下反应可以将汽车尾气中2种有
在铂-铑“三效”催化剂作用下,以下反应可以将汽车尾气中2种有查看答案和解析>>
科目:高中化学 来源: 题型:
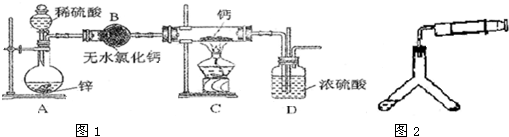
| 48.06 |
| 22400 |
查看答案和解析>>
科目:高中化学 来源: 题型:

| 物质 | 熔点/℃ | 沸点/℃ |
| 1-丁醇 | -89.5 | 117.3 |
| 1-溴丁烷 | -112.4 | 101.6 |
| 丁醚 | -95.3 | 142.4 |
| 1-丁烯 | -185.3 | -6.5 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、其它条件不变时,升高温度化学反应速率加快 |
| B、其它条件不变时,增大浓度化学反应速率加快 |
| C、当反应物的浓度与生成物的浓度相等时,化学反应达到化学平衡 |
| D、当正反应的速率与逆反应的速率相等时,化学反应达到化学平衡 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com