
����Ŀ��t��ʱ����һ�����Ϊ2L�ܱ������м��뷴Ӧ��A��B���������·�Ӧ��A(s)+2B(g)![]() 3C(g)����Ӧ�����еIJ����������±���ʾ������˵����ȷ����
3C(g)����Ӧ�����еIJ����������±���ʾ������˵����ȷ����
���� | ��ʼ | 2���� | 4���� | 6���� |
A | 2 mol | 1.2 mol | ||
B | 6 mol | 3.0 mol | ||
C | 0 mol | x mol | 4.5 mol |
A. ǰ2�����ڣ�A�ķ�Ӧ����Ϊ0.2molL-1min-1
B. ����x��ֵΪ3.6
C. 4����ʱ����Ӧ�ﵽƽ��״̬����ʱ�����淴Ӧ�����ʶ�Ϊ0
D. �����¶ȣ������淴Ӧ�����ʶ�������
���𰸡�D
��������
A(s) + 2B(g)![]() 3C(g)
3C(g)
��ʼ��mol�� 2 6 0
2���ӣ�mol�� 1.2 x=2.4
4���ӣ�mol�� 3 4.5
6���ӣ�mol�� 4.5
��������ʽ���Ƴ�4����ʱ��CΪ4.5 mol��4����ʱ����Ӧ�ʹﵽƽ��״̬�ˡ�
A. AΪ���壬Ũ��ʼ����һ���������ʲ�����A����ʾ�÷�Ӧ�����ʣ���A����
B. �����ʵ�ת�������ڻ�ѧ������֮�ȣ�����x��ֵΪ2.4����B����
C. 4����ʱ����Ӧ�ﵽƽ��״̬����ѧƽ��״̬��һ����̬ƽ�⣬��ʱ�����淴Ӧ�����ʶ���Ϊ0����C����
D. �����¶ȣ������淴Ӧ�����ʶ�������D��ȷ��
��ѡD��


 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ͨ���Ե���ˮ�������ۺ����ã����Ի�ö����л������֮���ת����ϵ���£�������ͬ�����ŵ��л���ͨ���������ƵĻ�ѧ���ʣ���

��֪B����Na2CO3��Ӧ��B�Ĵ��������ﲻ�ܷ���������Ӧ����1mol B�����������Ʒ�Ӧ����1mol H2��
��ش�
��1��D������������������___________����2��B�Ľṹ��ʽ��_______________��
��3��C+D��E�Ļ�ѧ����ʽ��____________��
��4������˵����ȷ����_________��
A����һС����Ͷ��C�У���ʼ�ո���Һ���ϻ����ų����ݣ�ͬʱ�õ���ʹ��̪��Һ��������
B����һ�������£�D��E����ͨ���Ӿ۷�Ӧ���ɸ߾���
C����mg A��B�Ļ��������������ȫȼ�գ�����22.4m/30 L����
D��B��Ũ���������·�Ӧ����������Ԫ��״������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���±��Ǽ���������ʵĵ���ƽ�ⳣ�������ܵ���ʵ��ܶȻ�Ksp��25 �棩��
����� | ƽ�ⷽ��ʽ | ƽ�ⳣ��K | Ksp |
CH3COOH | CH3COOH | 1.76��10-5 | |
H2CO3 | H2CO3 HCO3- | K1=4.31��10-4 K2=5.61��10-11 | |
C6H5OH | C6H5OH | 1.1��10-10 | |
H3PO4 | H3PO4 H2PO4- HPO42- | K1=7.52��10-3 K2=6.23��10-8 K3=2.20��10-13 | |
NH3��H2O | NH3��H2O | 1.76��10-5 | |
BaSO4 | BaSO4(s) | 1.0��10-10 | |
BaCO3 | BaCO3(s) | 2.5��10-9 |
�ش��������⣺
��1�����ϱ�����������CH3COOH����HCO3-����C6H5OH����H2PO4-���ɿ����ᣬ������������ǿ����_______�����ţ���
��2����C6H5ONa��Һ��ͨ������CO2��д����Ӧ�����ӷ���ʽ_____________________��
��3��25 ��ʱ�����������Ũ�ȵĴ���Ͱ�ˮ��ϣ����Һ�У�c(CH3COO-)______c(NH4+)���>������=����<������
��4��25 ��ʱ����10 mL 0.01 mol��L-1���ӣ�C6H5OH����Һ�еμ�V mL 0.01 mol��L-1��ˮ�����Һ������Ũ�ȹ�ϵ��ȷ����________��
A�������ҺpH>7����V��10
B�������ҺpH<7����c(NH4+)>c(C6H5O-)>c(H+)>c(OH-)
C��V=10ʱ�����Һ��ˮ�ĵ���̶�С��10 mL 0.01 mol��L-1������Һ��ˮ�ĵ���̶�
D��V=5ʱ��2c(NH3��H2O)+2c(NH4+)=c(C6H5O-)+c(C6H5OH)
��5����.��ͼ��ʾ����T1��T2�����¶�������BaSO4��ˮ�еij����ܽ�ƽ�����ߣ��ش��������⣺

��T2�¶�ʱKsp(BaSO4)=__________��
������T1�¶�ʱBaSO4�ij����ܽ�ƽ�����ߣ�����˵������ȷ����________��
A������Na2SO4��ʹ��Һ��a���Ϊb��
B����T1�����Ϸ����������ߣ�����һ��ʱ������BaSO4��������
C�������ܼ�����ʹ��Һ��d���Ϊ������a��b֮���ijһ�㣨����a��b��
D�����¿�ʹ��Һ��b���Ϊd��
��.����0.35mol��BaSO4������ÿ����1 L����Na2CO3��Һ�����ʵ���Ũ��Ϊ1.7 mol��L-1����������ʹBaSO4�е�SO42-ȫ��ת������Һ�У���Ҫ��������________�Ρ�[��ʾ��BaSO4(s)+CO32-(aq)![]() BaCO3(s)+SO42-(aq)]
BaCO3(s)+SO42-(aq)]
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����Ҫ��д�����з���ʽ��
��1���������ĵ��뷽��ʽ��___��
��2��BaCO3��ϡ������Һ��Ӧ�Ļ�ѧ����ʽ��____��
��3��ʵ�����������Ļ�ѧ����ʽ��____��
��4��д����ҵ��Ư�۵Ļ�ѧ����ʽ��____��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������л���A��B��C��Ϊͬ���칹�壬����C��H��O����Ԫ����ɣ��ҷ�����C��H��OԪ�ص�������Ϊ15:2:8������Է�������ͨ���������Ϊ100����֪������A�ܷ���������Ӧ������ֱ���ṹ����������3�ֲ�ͬ��ѧ�������⣬��ԭ�Ӹ�����Ϊ1:1:2��BΪ��Ԫ������C�ĺ�����ױ���������д��ڼ����������ʵ�ת����ϵ���£�

���������գ�
��1��A�ķ���ʽ��______________��A�����еĹ�����������_________________��
��2��B��G�Ľṹ��ʽ�ֱ���_____________��_____________��
��3��D��C��Ӧ�Ļ�ѧ����ʽΪ_________________________________________��
��4���ɵ���F�����Ӿ۷�Ӧ���ɵIJ���Ľṹ��ʽ��___________��
��5�������һ����![]() Ϊ��Ҫԭ���Ʊ�
Ϊ��Ҫԭ���Ʊ�![]() �ĺϳ�·��_____�����ϳ�·�߳��õı�ʾ��ʽΪ����
�ĺϳ�·��_____�����ϳ�·�߳��õı�ʾ��ʽΪ����![]() ��
��![]()
![]() Ŀ����
Ŀ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����Ҫ�����
��1���Ҵ�ͬ���칹��Ľṹ��ʽ__________����������Ҫ�ɷֵĻ�ѧʽ__________��
��2��������ˮ��Ӧ�����ӷ���ʽ____________________________________________��
��3����������������Һ��Ӧ�Ļ�ѧ����ʽ____________________________________��
��4��̼�����Ƶĵ��뷽��ʽ________________________________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������NOCl�����ںϳ������ȡ�������Cl2��NO�ڳ��³�ѹ�ºϳɣ������۵�Ϊ-64.5�棬�е�Ϊ-5.5�棬�������ǻ�ɫ���ж����壬��ˮ��ˮ�⡣ �밴Ҫ��ش�����������⣺
(1)������м��ϡ�����ַ�Ӧ�Ʊ�NO�����ӷ���ʽΪ��______________________��
(2)�Ʊ�NOCl��װ������ͼ��ʾ������˳��Ϊ:a��_________________________(�������������ҷ�����Сд��ĸ��ʾ)��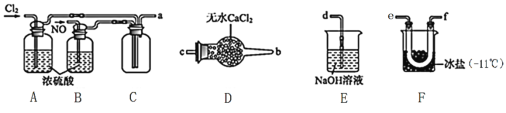
��װ��A��B�����Ǣٸ���NO��Cl2����___________________________________________��
��װ��D��������______________________________________��
��װ��E��NOCl������Ӧ�Ļ�ѧ����ʽΪ________________��
(3)��ҵ����������NOβ�����������ж��֣����м�ӵ绯ѧ������ԭ����ͼ��ʾ��

�ù����������ĵ缫��ӦʽΪ��__________________________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵����ȷ����
A. ��Ӧ 2Mg+CO2 ![]() 2MgO+C��H��0 ���ر�Ƕȿ������Է�����
2MgO+C��H��0 ���ر�Ƕȿ������Է�����
B. ���ܱ������������淴Ӧ��2NO(g)+2CO(g)N2(g)+2CO2(g)��H=��113.0kJ/mol���ﵽƽ������¶Ȳ�������С������������´ﵽƽ�������H ��С
C. ���� HClO �� Ka=3.0��108��H2CO3 �� Ka1=4.3��107��Ka2=5.6��1011�����Ʋ���ͬ״�� �£���Ũ�ȵ� NaClO �� Na2CO3 ��Һ�У�pH ǰ��С�ں���
D. ��֪��Ksp(AgCl)=1.8��1010��Ksp(Ag2CrO4)=2.0��1012���������Ũ��Ϊ1.0��10��4mol/L �� AgNO3 ��Һ���뵽Ũ�Ⱦ�Ϊ 1.0��10��4mol/L �� KCl �� K2CrO4 �Ļ����Һ�в������ֲ�ͬ�������� Ag2CrO4 �����Ȳ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ����Ǧ����Ϊ��Դ��ģ���ȼҵ��ⱥ��ʳ��ˮ��װ��ͼ��C��D��Ϊʯī�缫�������һ��ʱ������ڵ�����C��һ�������������ɫ��ζ��D��һ�����������ʻ���ɫ�д̼�����ζ����ش��������⣺

��1����֪Ǧ�����ڷŵ�ʱ�����ķ�Ӧ��Pb+PbO2+4H++2SO42-=2PbSO4+2H2O����A���ĵ缫��ӦΪ___________________________��
��2����ⱥ��ʳ��ˮ�����ӷ�Ӧ����ʽ��__________________��
��3���缫C�ĵ缫��Ӧ��_____________________________________________��
��4�����ʱΪ��ֹ������������ϣ��������ӽ���Ĥ����Ĥ������ʱNa+��______��������_____�������C����D������
��5������·����0.2mol���ӵĵ���ͨ������Ǧ��������������_________mol��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com