
| A. | 3种 | B. | 4种 | C. | 6种 | D. | 8种 |
 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
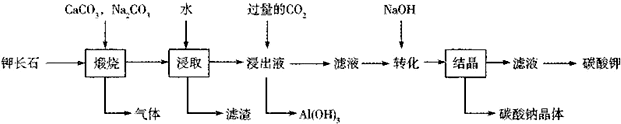
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | pH=2与pH=1的CH3COOH溶液中c(H+)之比为1:10 | |
| B. | 0.1 mol•L-1的CH3COOH溶液中,由水电离的c(H+)为10-13 mol•L-1 | |
| C. | 常温下,等体积pH=12的NaOH溶液和pH=2的CH3COOH溶液混合,混合后溶液pH<7 | |
| D. | 1.0 mol•L-1Na2CO3溶液:c(OH-)═c(HCO3-)+c(H+)+2c(H2CO3) |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 四种元素中原子半径最大的为Z | |
| B. | Y、Z、M的氢化物中,M的氢化物最稳定 | |
| C. | 四种元素最多可形成两种盐 | |
| D. | 由四种元素中的两种形成的相对分子质量最小的有机物不能发生加成反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该溶液中,H+、Al3+、Cl?能大量共存 | |
| B. | 溶液中c(H2CO3)<c(CO32?) | |
| C. | 该溶液中阳离子总数大于阴离子总数 | |
| D. | 常温下,加水稀释,$\frac{c({H}^{+}).c(C{O}_{3}^{2-})}{c(HC{O}_{3}^{-})}$变小 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
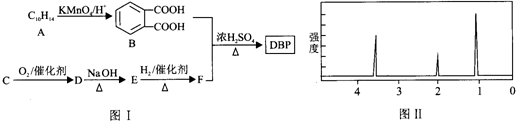
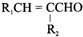 +H2O(R1、R2示氢原子或烃基)
+H2O(R1、R2示氢原子或烃基) .
.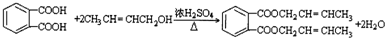 .
.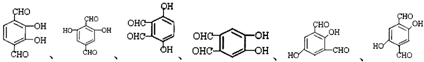 任意2种(填结构简式).
任意2种(填结构简式).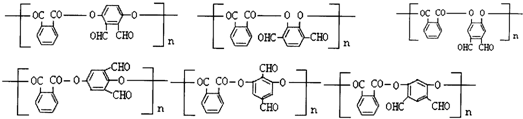 任意一种(填结构简式).
任意一种(填结构简式).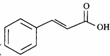 ) 的合成路线
) 的合成路线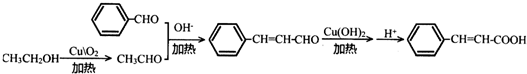 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 42g丙烯和环丙烷的混合气体中所含极性键的数目为9NA | |
| B. | 12g石墨烯(单层石墨)中含有六元环的数目为0.5NA | |
| C. | 室温下,1L pH=13的NaOH溶液中,由水电离出的OH-的数目为0.1NA | |
| D. | 3.6 g CaO2晶体中阴离子的数目为0.1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
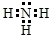 ;由A、D两元素可以组成X、Y两种化合物,X在一定条件下可以分解成Y,X中所含化学键类型极性键、非极性键;(填写“极性共价键”、“非极性共价键”、“离子键”)向X中加入酸性KMnO4溶液,写出二者恰好反应的离子方程式5H2O2+2MnO4-+6H+=5O2↑+2Mn2++8H2O;
;由A、D两元素可以组成X、Y两种化合物,X在一定条件下可以分解成Y,X中所含化学键类型极性键、非极性键;(填写“极性共价键”、“非极性共价键”、“离子键”)向X中加入酸性KMnO4溶液,写出二者恰好反应的离子方程式5H2O2+2MnO4-+6H+=5O2↑+2Mn2++8H2O;查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com