
| 选项 | 操作 | 现象 | 结论 |
| A | 将浓硫酸滴到蔗糖表面 | 固体变黑膨胀 | 浓硫酸有脱水性和强氧化性 |
| B | 常温下将Al片放入浓硝酸中 | 无明显变化 | Al与浓硝酸不反应 |
| C | 二氧化硫通入品红溶液中 | 品红溶液褪色 | 二氧化硫具有还原性 |
| D | 将水蒸气通过灼热的铁粉 | 粉末变红 | 铁与水在高温下发生反应 |
| A、A | B、B | C、C | D、D |


科目:高中化学 来源: 题型:
| A、CaCO3的电离方程式:CaCO3?Ca2++CO32- |
| B、HCO3-的水解方程式:HCO3-+H2O?H3O++CO32- |
| C、CO32-的水解方程式:CO32-+2H2O?H2CO3+2OH- |
| D、BaSO4的沉淀溶解平衡表达式:BaSO4(s)?Ba2+(aq)+SO42-(aq) |
查看答案和解析>>
科目:高中化学 来源: 题型:
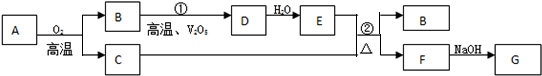
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、若温度不变,将容器的体积缩小到原来的一半,此时A的浓度变为原来的2.1倍,则m+n<p+q | ||
| B、若平衡时,A、B的转化率相等,说明反应开始时,A、B的物质的量之比为m:n | ||
| C、若m+n=p+q,则往含有a mol气体的平衡体系中再加入amolB,达到新平衡时,气体的总物质的量等于2a | ||
D、若温度不变时将压强增大至原来的2倍,达到新平衡时,总体积一定比原体积的
|
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、在常温常压下,11.2L氯气含有的分子数为0.5NA . |
| B、标准状况下,2.24L H2O 含有的分子数等于0.1NA . |
| C、1mol H2 与1mol Cl2 反应生成NA 个HCl |
| D、标准状况下,22.4LN2 和O2混合气体中所含有原子数为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 浓硫酸 |
| 密度(g/mL) | 熔点(℃) | 沸点(℃) | 溶解性 | |
| 冰醋酸 | 1.049 | 16.6 | 118.1 | 能溶于水 |
| 异戊醇 | 0.812 | -117.2 | 130.5 | 微溶于水 |
| 乙酸异戊酯 | 0.869 | -78 | 140 | 难溶于水 |
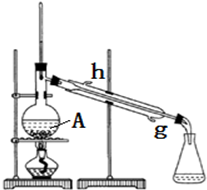
查看答案和解析>>
科目:高中化学 来源: 题型:
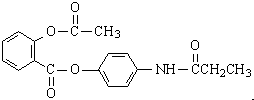 ,由它可衍生出一系列物质,有关变化如图:
,由它可衍生出一系列物质,有关变化如图:
查看答案和解析>>
科目:高中化学 来源: 题型:
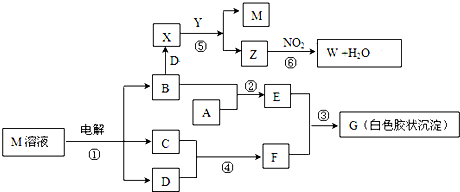
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、11.4g | B、16.5g |
| C、9.7g | D、8.7g |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com