
【题目】NA表示阿伏加德罗常数,下列叙述正确的是
A. 等质量的N2和CO所含分子数均为NA
B. 1 mol·L-1 NaCl溶液中含有Cl-的个数为NA
C. 常温常压下,48 g O2和48 g O3 含有的氧原子数均为3NA
D. 标准状况下,22.4 L的水中含有NA个H2O分子
【答案】C
【解析】
A、根据![]() ,没有气体的质量,不能计算物质的量;根据
,没有气体的质量,不能计算物质的量;根据![]() ,没有溶液体积,不能计算溶质物质的量;48 g O2的物质的量是
,没有溶液体积,不能计算溶质物质的量;48 g O2的物质的量是![]() ,48 g O3的物质的量是
,48 g O3的物质的量是![]() ;标准状况下水是液体,不能根据
;标准状况下水是液体,不能根据![]() 计算物质的量。
计算物质的量。
A、根据![]() ,没有气体的质量,不能计算物质的量,等质量的N2和CO的物质的量相等,但不一定是1mol,故A错误;根据
,没有气体的质量,不能计算物质的量,等质量的N2和CO的物质的量相等,但不一定是1mol,故A错误;根据![]() ,没有溶液体积,不能计算溶质物质的量,故B错误;48 g O2的物质的量是
,没有溶液体积,不能计算溶质物质的量,故B错误;48 g O2的物质的量是![]() ,含氧原子1.5mol
,含氧原子1.5mol![]() 2=3mol;48 g O3的物质的量是
2=3mol;48 g O3的物质的量是![]() ,含氧原子1mol
,含氧原子1mol![]() 3=3mol,故C正确;标准状况下水是液体,不能根据
3=3mol,故C正确;标准状况下水是液体,不能根据![]() 计算物质的量,22.4 L的水物质的量不是1mol,故D错误。
计算物质的量,22.4 L的水物质的量不是1mol,故D错误。


 阳光课堂同步练习系列答案
阳光课堂同步练习系列答案科目:高中化学 来源: 题型:
【题目】反应3A(g)+B(g)![]() 2C(g)+2D(s)在2 L密闭容器中进行,经过4min,B减少了0.4 mol,则0~4min内此反应的平均速率为
2C(g)+2D(s)在2 L密闭容器中进行,经过4min,B减少了0.4 mol,则0~4min内此反应的平均速率为
A. v(A)=0.15 mol·L1B. v(B)=0.05 mol·L1·s1
C. v(C)=0.10 mol·L1·min1D. v(D)=0.10 mol·L1·min1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期主族元素W、Ⅹ、Y、Z的原子序数依次增加。A是元素Y的单质。常温下A遇甲的浓溶液钝化。丙、丁、戊是由这些元素组成的二元化合物,且丙是无色气体。上述物质的转化关系如图所示。下列说法正确的是

A. 丁和戊中所含化学键类型完全相同
B. 简单离子的半径大小:X>Y
C. 简单阴离子的还原性:X>Z
D. Y与Z的简单化合物不与水反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】过滤在实验、生产、生活中有着广泛的应用。某研究性学习小组在实验室测定某含NaCl杂质的碳酸钠样品中Cl-的含量,其实验步骤如下:
①将100g样品溶于水得到溶液A。
②向A中加入稀HNO3酸化后,再加入沉淀剂B,使Cl-完全沉淀下来。
③进行如图所示操作,得到固体C,洗涤,干燥。
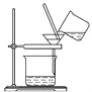
④称量得固体C的质量为2.87 g。
(1)沉淀剂B为________(填化学式)。
(2)向A中加入稀HNO3酸化的目的是_______________________。
(3)如何洗涤固体C: __________________。如果得到固体C后直接干燥、称量,会使样品中氯元素的质量分数________(填“偏大”“偏小”或“不变”)。
(4)该样品中氯元素的质量分数为________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各种说法中错误的是:
①化学反应除了生成新物质外,还伴随着能量的变化;②同温同压下,H2 (g)+Cl2 (g)==2HCl(g)在光照和点燃条件下的反应热ΔH不同;③为防治酸雨、降低工业废气,常用生石灰进行“钙基固硫”:CaO+SO2= CaSO3、2CaSO3+O2![]() 2CaSO3;④开发太阳能、风能、地热能、潮汐能等新能源,可减少雾霾、保护环境;⑤煤的气化和液化技术,可高效、清洁地利用煤;⑥从海水提镁的过程为:MgCl2(aq)
2CaSO3;④开发太阳能、风能、地热能、潮汐能等新能源,可减少雾霾、保护环境;⑤煤的气化和液化技术,可高效、清洁地利用煤;⑥从海水提镁的过程为:MgCl2(aq)![]() Mg(OH)2
Mg(OH)2![]() MgO
MgO![]() Mg
Mg
A. ①③④ B. ②⑥ C. ①④⑤ D. ③④⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NaC1O3可用于制取二氧化氯、亚氯酸钠及高氯酸盐等。以原盐(主要成分为NaC1)为原料制备氯酸钠的工艺流程如下:
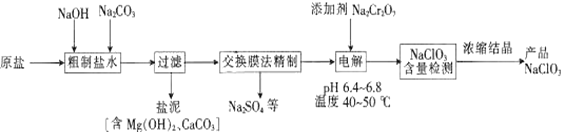
已知:Cr2O72-+H2O![]() 2CrO42-+2H+。
2CrO42-+2H+。
回答下列问题:
(1)“粗制盐水”中加入NaOH和Na2CO3的目的是___________________。
(2)过滤时,使用的玻璃仪器有烧杯、玻璃棒和____________。
(3)在pH:6.4~6.8,温度:40~50℃的条件下电解,理论上最终产物只有NaC1O3。电解时阳极的产物为C12,溶液中发生的反应有C12+H2O====HC1O+H++C1-,HC1O![]() H++C1O-和__________。
H++C1O-和__________。
(4)电解槽中温度不宜过高,其原因是_________________________。加入的Na2Cr2O7可以调节电解液酸度,若酸度过大,则电解液中主要存在__________(填“Cr2O72-”或“CrO42-”)。
(5)为检测电解后盐水中NaC1O3的物质的量浓度进行下列实验:
I.准确吸取10.00mL电解后的盐水,加入适量的3%H2O2溶液充分搅拌并煮沸。
Ⅱ.准确吸取0.10mol·L-1的(NH4)2Fe(SO4)2标准溶液25.00 mL于300mL锥形瓶中,加入足量稀硫酸。
III.将I的溶液加入Ⅱ的锥形瓶中,隔绝空气煮沸10min,加热充分反应。冷却至室温后,加入10mL0.4mol·L-1MnSO4溶液、5mL 85%磷酸溶液,用c mol·L-1的KMnO4标准溶液滴定剩余的Fe2+至溶液变为微红色,即滴定终点,此时消耗高锰酸钾V mL。
①步骤I中加入H2O2溶液的作用是______________________。
②步骤Ⅱ中C1O3-被Fe2+还原为C1-的离子方程式为________________________。
③该盐水中NaC1O3的物质的量浓度为________mol·L-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于可逆反应:mA(g)+nB(g) ![]() pC(g)+qD(g)(m、n、p、q均为化学计量数),根据图示曲线回答:
pC(g)+qD(g)(m、n、p、q均为化学计量数),根据图示曲线回答:
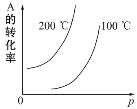
(1)正反应是___热反应。
(2)m+n___p+q(填“>”“<”或“=”)。
(3)若将纵坐标A的转化率换成A在平衡混合物中的质量分数,则逆反应是____ 热反应,m+n___p+q(填“>”“<”或“=”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有机反应方程式书写正确的是
A. 甲烷与氯气的取代反应:CH4+Cl2![]() CH2Cl2+H2
CH2Cl2+H2
B. 苯与硝酸的硝化反应:![]() +HNO3
+HNO3![]()
![]() +H2O
+H2O
C. 乙醇的催化氧化反应:CH3CH2OH+O2![]() CH3CHO+H2O
CH3CHO+H2O
D. 乙酸与乙醇的酯化反应:CH3COOH+CH3CH2OH![]() CH3COOCH2CH3
CH3COOCH2CH3
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com