
分析 (1)草酸钠在溶液中的水解分步进行,主要以第一步为主,水解的离子方程式只写出第一步即可;
(2)欲使平衡向左移动,且所得溶液显酸性,加入的物质抑制了水的电离,应该加入酸性较强的物质,如H2SO4、CH3COOH、NH4HSO4;
(3)浓度相同时,铵根离子部分水解,导致铵根离子浓度减小;根据氯化铵和氯化钠溶液中的物料守恒分析;
(4)溶液pH大小:一元强碱溶液>弱碱>不水解的盐>水解显酸性的盐>弱酸>一元强酸,据此分析判断溶液pH大小;
(5)⑨为强酸性溶液,pH相同时其溶液浓度最小,铵根离子浓度最小;⑤、⑦溶液显示酸性都是铵根离子水解引起的,则pH相同时⑤、⑦溶液的浓度相等;
(6)硫酸为强酸、醋酸为弱酸,pH相同时醋酸浓度较大,且稀释过程中醋酸的电离程度增大,所以稀释后溶液的pH相同时,稀释醋酸的倍数较大;
(7)氯化铵是强酸弱碱盐,由于NH4+水解,导致溶液中c(NH4+)<c(Cl-),氢离子浓度大于氢氧根离子浓度,溶液呈酸性;为了使NH4+与Cl-的浓度比为1:1的溶液,须加一定量的能电离出铵根离子的物质,或减少溶液中氯离子的浓度,据此分析.
解答 解:(1)⑧Na2C2O4溶液中,C2O42水解分步进行,主要以第一步为主,其水解的离子方程式为:C2O42-+H2O?OH-+HC2O4-,
故答案为:C2O42-+H2O?OH-+HC2O4-;
(2)已知水存在如下平衡:H2O+H2O?H3O++OH-,现欲使平衡向左移动,且所得溶液显酸性,应该显示酸类物质,如::①H2SO4②CH3COOH ⑨NH4HSO4,
故答案为:①②⑨;
(3)浓度均为0.1mol?L-1的③⑤溶液比较,由于铵根离子部分水解,则:c(Na+)>c(NH4+);
浓度均为 0.1mol?L-1的③⑤溶液等体积混合后,根据物料守恒可得:c(Na+)+c(NH4+)+c(NH3?H2O)=c(Na+)+c(Cl-),
故答案为:>;c(Na+)+c(Cl-);
(4)浓度相同的①H2SO4 ②CH3COOH ③NaCl ④NaOH,⑤NH4Cl,⑥NH3•H2O溶液,①为二元强酸,其溶液中氢离子浓度最大,溶液的pH最小;②为一元弱酸,溶液的pH仅大于①;③为中性溶液;④为一元强碱,其溶液的pH最大;⑤为强酸弱碱盐,溶液的pH<7;⑥为弱酸,其溶液的pH仅小于④,所以浓度相同的六种溶液的pH大小为:④>⑥>③>⑤>②>①,
故答案为:④>⑥>③>⑤>②>①;
(5)pH相同的⑤NH4Cl,⑦(NH4)2SO4,⑨NH4HSO4,⑨为强酸性溶液,其溶液浓度最小,铵根离子浓度最小;⑤⑦溶液显示酸性都是铵根离子水解引起的,则pH相同时⑤⑦溶液的浓度相等,所以pH相同时铵根离子浓度大小为:⑤=⑦>⑨,
故答案为:⑤=⑦>⑨;
(6)pH均为4,等体积的①和②溶液分别加水稀释n倍、m倍,由于醋酸为弱酸、硫酸为强酸,则稀释后两种溶液的pH都变成6,醋酸稀释的倍数较大,即:m>n,
故答案为:>;
(7)氯化铵是强酸弱碱盐,由于NH4+水解,导致溶液中c(NH4+)<c(Cl-),溶液呈酸性,为了使NH4+与Cl-的浓度比为1:1的溶液,可加入适量的醋酸铵溶液,溶液中铵离子浓度增大,可以满足c(NH4+)=c(Cl-),或加入适量氨水,增大了溶液中铵根离子的浓度,并保持氯离子浓度不变,可以满足c(NH4+)=c(Cl-),
故答案为:加入适量的醋酸铵溶液(或加入适量氨水).
点评 本题考查较为综合,涉及离子浓度大小比较、盐的水解原理及其应用、弱电解质的电离等知识,题目难度中等,明确盐的水解原理、弱电解质的电离平衡及其影响为解答关键,试题知识点较大、综合性较强,充分考查了学生的分析、理解能力及灵活应用能力.


 天天向上口算本系列答案
天天向上口算本系列答案科目:高中化学 来源: 题型:解答题
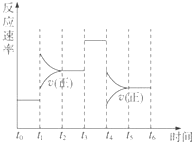 在体积固定的密闭体系中发生下列反应:
在体积固定的密闭体系中发生下列反应:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②④⑥⑦ | B. | ①②⑤⑥ | C. | ④⑥⑧⑨ | D. | ①②④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
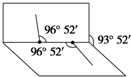 解答下列问题,本题共两个小题.
解答下列问题,本题共两个小题.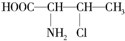 ,一个该有机物分子中含有2个手性碳原子.其中一对对映异构体用简单的投影式表示为:
,一个该有机物分子中含有2个手性碳原子.其中一对对映异构体用简单的投影式表示为: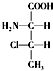 和
和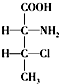 ,则另一对对映异构体的简单投影式为:
,则另一对对映异构体的简单投影式为: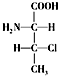 和
和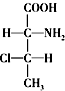 .②②
.②②查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2H2+O2→2H2O+142.9kJ | B. | 2H2(g)+O2(g)→2H2O(l)+142.9kJ | ||
| C. | 2H2(g)+O2(g)→2H2O(l)+571.6kJ | D. | H2O(l)→H2(g)+$\frac{1}{2}$O2(g)-142.9kJ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 充放电时,溶液的导电能力变化不大 | |
| B. | 电解稀硫酸可能发生的反应是:Cu+H2SO4 $\frac{\underline{\;电解\;}}{\;}$ CuSO4+H2↑ | |
| C. | 充电时,铅酸蓄电池的阴极与外接电源的正极相连 | |
| D. | 充电时的阳极反应式为:Pb+4OH-+2e-═PbO2+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Ca(ClO)2溶液中通入少量SO2:Ca2++2ClO-+SO2+H2O═CaSO3↓+2HClO | |
| B. | Ca(HCO3)2溶液与少量NaOH溶液反应:HCO${\;}_{3}^{-}$+OH-+Ca2+═CaCO3↓+H2O | |
| C. | C6H5ONa溶液中通入少量CO2:2C6H5O-+CO2+H2O-→2C6H5OH+CO${\;}_{3}^{2-}$ | |
| D. | 用惰性电极电解MgCl2溶液:2H2O+2Cl-$\frac{\underline{\;电解\;}}{\;}$Cl2↑+H2↑+2OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
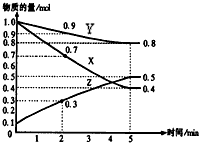 在某温度时,在2L容器中X、Y、Z三种气体物质的量随时间的变化关系曲线如图所示.
在某温度时,在2L容器中X、Y、Z三种气体物质的量随时间的变化关系曲线如图所示.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com