
| A. | 标准状况下,将22.4LHCl溶于1L水,可配成1mol•L-l的稀盐酸 | |
| B. | 将100mL18mol•L-1的浓H2SO4和100mL水混合,可配成9moI•L-l的H2SO4溶液 | |
| C. | 将4.0gNaOH溶于100mL容量瓶中,加水至刻度线,配成1mol•L-1的NaOH溶液 | |
| D. | 将0.1molNaCl配成100mL溶液,从中取出10mL,所取出溶液的物质的量浓度为1mol•L-1 |
分析 A.标况下,22.4LHCl的物质的量是1mol,1molHCl溶于1L水,溶于体积大于1L,根据c=$\frac{n}{V}$判断;
B.浓硫酸密度大于水,100mL浓硫酸和100mL水混合后溶液体积小于200mL;
C.容量瓶只能用来配制一定物质的量浓度溶液,不能溶解、稀释药品,NaOH溶于水放热,溶液有热胀冷缩性质;
D.溶液浓度具有均一性,溶液浓度与体积大小无关.
解答 解:A.标况下,22.4LHCl的物质的量是1mol,1molHCl溶于1L水,溶于体积大于1L,根据c=$\frac{n}{V}$知,溶液浓度小于1mol/L,故A错误;
B.浓硫酸密度大于水,100mL浓硫酸和100mL水混合后溶液体积小于200mL,则二者混合后溶液物质的量浓度大于9mol/L,故B错误;
C.容量瓶只能用来配制一定物质的量浓度溶液,不能溶解、稀释药品,NaOH溶于水放热,溶液有热胀冷缩性质,将4.0gNaOH溶于100mL容量瓶中,加水至刻度线,冷却至室温后溶液体积小于100mL,则配成的NaOH溶液浓度大于1mol/L,故C错误;
D.溶液浓度具有均一性,溶液浓度与体积大小无关,所以将0.1molNaCl配成100mL溶液,从中取出10mL,所取出溶液的物质的量浓度为1mol•L-1,故D正确;
故选D.
点评 本题考查物质的量浓度有关计算,为高频考点,侧重考查学生分析判断、计算能力,正确理解c=$\frac{n}{V}$中各个字母含义是解本题关键,易错选项是C.


科目:高中化学 来源: 题型:实验题
| 滴定次数 实验数据 | 1 | 2 | 3 | 4 |
| V(待测液)/mL | 20.00 | 20.00 | 20.00 | 20.00 |
| V(NaOH)/mL(初读数) | 0.00 | 0.200 | 0.10 | 0.00 |
| V(NaOH)/mL(终读数) | 14.95 | 15.20 | 15.15 | 16.95 |
| V(NaOH)/mL(消耗) | 14.95 | 15.00 | 15.05 | 16.95 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在气体发生装置上点燃氢气等气体时,必须先检验气体的纯度 | |
| B. | 加热灼烧后的坩锅放置在实验桌上冷却至室温 | |
| C. | 若不小心打翻酒精灯使酒精着火时,应用湿抹布盖灭 | |
| D. | 蒸馏操作过程中,若发现忘加沸石,应立即停止加热,待烧瓶冷却后再加入沸石 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 放热反应在常温下都很容易发生 | |
| B. | 吸热反应不加热就不会发生 | |
| C. | 需要加热才能发生的反应都是吸热反应 | |
| D. | 根据反应物和生成物具有总能量的相对大小可确定反应热 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 分子总数为NA的NO2和CO2混合气体中含有的氧原子数为2NA | |
| B. | 0.5molO3与11.2LO2所含的分子数一定相等 | |
| C. | 物质的量浓度为0.5mol/L MgCl2溶液,含有Cl-数为NA | |
| D. | 1molFe与足量稀盐酸反应时,转移电子的数目为3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 用一张已除去表面氧化膜的铝箔紧紧包裹在试管外壁(如图),将试管浸入硝酸汞溶液中,片刻取出,然后置于空气中,不久铝箔表面生出“白毛”,红墨水柱右端上升.根据实验现象判断下列说法错误的是( )
用一张已除去表面氧化膜的铝箔紧紧包裹在试管外壁(如图),将试管浸入硝酸汞溶液中,片刻取出,然后置于空气中,不久铝箔表面生出“白毛”,红墨水柱右端上升.根据实验现象判断下列说法错误的是( )| A. | 实验中发生的反应都是化合反应 | B. | 铝是一种较活泼的金属 | ||
| C. | 铝与氧气反应放出大量的热量 | D. | 铝片上生成的白毛是氧化铝 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 56g金属铁完全反应时失去的电子数为一定为2NA | |
| B. | 18g水所含的电子数目为NA | |
| C. | 在常温常压下,48g氧气和臭氧的混合气体所含的原子数目为3NA | |
| D. | 在常温常压下,11.2L二氧化硫所含的分子数目为0.5 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
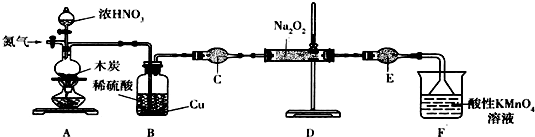
| 次数 | 2 | 3 | ||
| KMnO体积/m | 20.60 | 20.02 | 20.00 | 9.98 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com