

(1)左瓶中气体颜色_______,简述理由__________________________________________。
(2)右瓶中气体颜色_______,简述理由__________________________________________。
科目:高中化学 来源: 题型:阅读理解
| ||
| ||


| 32m2 |
| 233m1 |
| 32m2 |
| 233m1 |

| 实验次数 | 第一次 | 第二次 | 第三次 |
| 消耗KMnO4溶液体积/mL | 26.42 | 25.05 | 24.95 |
查看答案和解析>>
科目:高中化学 来源:专项题 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:

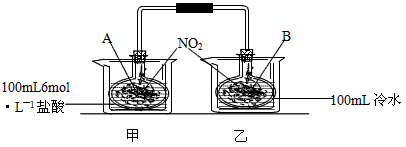
(1)A瓶中气体的颜色_______,简述理由:____________________________________。?
(2)B瓶中气体的颜色_______,简述理由:____________________________________。?
查看答案和解析>>
科目:高中化学 来源: 题型:

(1)A瓶中气体的颜色 ,简述理由 。
(2)B瓶中气体的颜色 ,简述理由 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com