
【题目】生活中的消毒剂酒精、含氯消毒剂、过氧乙酸等均可有效灭活病毒。病毒对紫外线和热敏感。下列有关说法正确的是
A.84消毒液的主要有效成分是![]()
B.过氧乙酸![]() 可作为消毒剂,与苯酚混合使用杀菌能力更强
可作为消毒剂,与苯酚混合使用杀菌能力更强
C.加热能杀死病毒是因为蛋白质受热变性
D.聚丙烯树脂是生产无纺布口罩的初始原料之一,聚丙烯可以使酸性高锰酸钾溶液褪色
科目:高中化学 来源: 题型:
【题目】化学与科学、技术、社会和环境密切相关。下列有关说法正确的是
A.煤的气化和液化是物理变化,煤的干馏是化学变化
B.乙醇、过氧化氢、次氯酸钠等消毒液均可以将病毒氧化而达到消毒的目的
C.氢氧燃料电池发电,比氢气直接在空气中燃烧发电能量转换率高
D.合成氨反应N2(g) +3H2(g)![]() 2NH3(g) △H<0,加入催化剂能加快反应速率并提高转化率
2NH3(g) △H<0,加入催化剂能加快反应速率并提高转化率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中科院大连化学物理研究所设计了一种新型Na-Fe3O4/HZSM-5多功能复合催化剂,成功实现了CO2直接加氢制取高辛烷值汽油,该研究成果被评价为“CO2催化转化领域的突破性进展”。
(1)已知:2H2(g)+O2(g)=2H2O(l) ΔH=-571.6kJ·mol-1
C8H18(l)+![]() O2(g)=8CO2(g)+9H2O(l) ΔH=-5518kJ·mol-1
O2(g)=8CO2(g)+9H2O(l) ΔH=-5518kJ·mol-1
则8CO2(g)+25H2(g)=C8H18(l)+16H2O(l) ΔH=___kJ·mol-1。
(2)氨硼烷(NH3BH3)是储氢量最高的材料之一,氨硼烷还可作燃料电池,其工作原理如图1所示。氨硼烷电池工作时正极的电极反应式为__________。
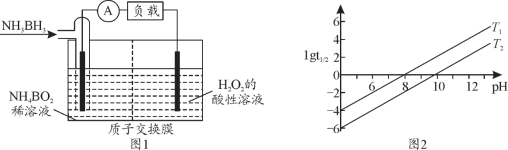
(3)常见含硼的化合物有NaBH4、NaBO2,已知NaBH4溶于水生成NaBO2、H2,写出其化学方程式_______。![]() 为NaBH4反应的半衰期(反应一半所需要的时间,单位为min)。lgt1/2随pH和温度的变化如图2所示,则T1______T2(填“>”或“<”)。
为NaBH4反应的半衰期(反应一半所需要的时间,单位为min)。lgt1/2随pH和温度的变化如图2所示,则T1______T2(填“>”或“<”)。
(4)燃油汽车尾气含有大量的NO,在活化后的V2O5催化作用下,氨气将NO还原成N2的一种反应历程如图3所示。
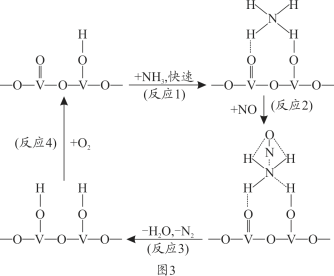
根据图写出总反应的化学方程式_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】试用VSEPR理论判断下列分子或离子的立体构型,并判断中心原子的杂化类型:
(1)H2O____________形,杂化类型_________;
(2)CO32-__________形,杂化类型_________;
(3)SO32-__________形,杂化类型_________;
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氰(CN)2,硫氰(SCN)2等称为拟卤素,与卤素单质性质相似,它们的阴离子与也卤素阴离子性质相似,阴离子的还原性顺序为: Cl-<Br-<CN-<SCN-<I-,又知,拟卤素形成的无氧酸和含氧酸一般为弱酸,下列反应中,不合理的是
A.4HCN(浓)+MnO2![]() Mn(CN)2+(CN)2↑+2H2O
Mn(CN)2+(CN)2↑+2H2O
B.(CN)2+H2O=2H++CN-+CNO-
C.(CN)2+2OH-=CN-+CNO-+H2O
D.(CN)2+2SCN-=2CN-+(SCN)2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲硅烷广泛用于电子工业、汽车领域,三氯氢硅(SiHCl3)是制备甲硅烷的重要原料。回答下列问题:
(1)工业上以硅粉和氯化氢气体为原料生产SiHCl3时伴随发生的反应有:
Si(s)+4HCl(g)= SiCl4(g)+2H2(g) H=-241kJ/mol
SiHCl3(g)+HCl(g)=SiCl4(g)+H2(g) H=-31kJ/mol
以硅粉和氯化氢气体生产SiHCl3的热化学方程式是____________________________。
(2)工业上可用四氯化硅和氢化铝锂(LiAlH4)制甲硅烷,反应后得甲硅烷及两种盐。该反应的化学方程式为_________________。
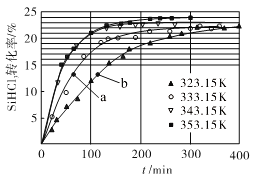
(3)三氯氢硅歧化也可制得甲硅烷。反应2SiHCl3(g) ![]() SiH2Cl2(g)+SiCl4(g)为歧化制甲硅烷过程的关键步骤,此反应采用一定量的PA100催化剂,在不同反应温度下测得SiHCl3的转化率随时间的变化关系如图所示。
SiH2Cl2(g)+SiCl4(g)为歧化制甲硅烷过程的关键步骤,此反应采用一定量的PA100催化剂,在不同反应温度下测得SiHCl3的转化率随时间的变化关系如图所示。
①353.15K时,平衡转化率为_________,反应的平衡常数K=________(保留3位小数)。该反应是________反应(填“放热”“吸热”)。
②323.15K时,要缩短反应达到平衡的时间,可采取的措施有_________、__________。
③比较a、b处反应速率的大小:va_____vb (填“>”“<”或“=”)。已知反应速率v正=![]() ,v逆=
,v逆=![]() ,k1、k2分别是正、逆反应的速率常数,与反应温度有关,x为物质的量分数,则在353.15K时
,k1、k2分别是正、逆反应的速率常数,与反应温度有关,x为物质的量分数,则在353.15K时![]() =________(保留3位小数)。
=________(保留3位小数)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,在 100 mL 12 mol·L-1 的浓硝酸中加入足量的铁粉,最终产生标准状况下气体的体积为(不考虑 NO2 转化为 N2O4)( )
A.介于 6.72 L 至 13.44 L 之间
B.等于 6.72 L
C.等于 13.44 L
D.几乎无气体产生
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】若将 SO2 通入硝酸钡溶液中,有白色沉淀产生,其化学反应方程式如下(未配平): SO2+ Ba(NO3)2+ H2O —— BaSO4↓+ HNO3+ NO↑
(1)配平上述化学反应方程式并用双线桥表示电子转移的方向和数目________。
(2)该反应中,_______发生氧化反应,氧化剂是_______。氧化产物与还原产物的物质的量之比为 _______。
(3)当反应消耗二氧化硫 19.2 g 时,反应中转移电子数目为_______ ,生成 NO 的体积为 _______(标准状况)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某仅由碳、氢、氧三种元素组成的有机化合物,经测定其相对分子质量为90。取有机物样品1.8 g,在纯氧中完全燃烧,将产物先后通过浓硫酸和碱石灰,两者分别增重1.08 g和2.64 g。试求该有机物的分子式。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com