
【题目】化合物 H 是一种抗病毒药物,在实验室中利用芳香烃 A 制备 H 的流程如下图所示(部分反应条件已略去):
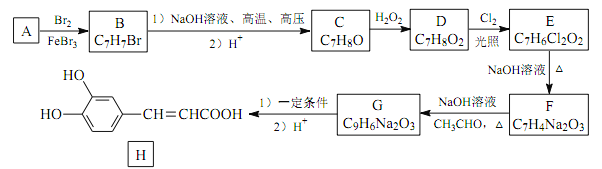
己知: ①有机物 B 苯环上只有两种不同环境的氢原子;
②两个羟基连在同一碳上不稳定,易脱水形成羰基或醛基;
③ RCHO + CH3CHO NaOH![]() RCH CHCHO + H2O;
RCH CHCHO + H2O;
④
(1)有机物 B 的名称为_____。
(2)由 D 生成 E 的反应类型为___________ , E 中官能团的名称为_____。
(3)由 G 生成 H 所需的“一定条件” 为_____。
(4)写出 B 与 NaOH 溶液在高温、 高压下反应的化学方程式:_____。
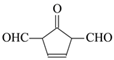
(5)F 酸化后可得 R, X 是 R 的同分异构体, X 能发生银镜反应,且其核磁共振氢谱显示有 3 种不同化学环境的氢,峰面积比为 1∶1∶1,写出 2 种符合条件的 X 的结构简式:_____。
(6)设计由 ![]() 和丙醛合成
和丙醛合成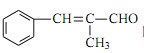 的流程图:_______________(其他试剂任选)。
的流程图:_______________(其他试剂任选)。
【答案】 对溴甲苯(或4-溴甲苯) 取代反应 羟基、氯原子 银氨溶液、加热(或新制氢氧化铜、加热) 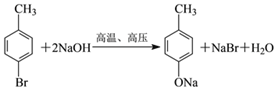
![]() 、
、 (或其他合理答案)
(或其他合理答案) ![]()
【解析】根据流程图及已知信息:
(1)有机物 B 的名称为对溴甲苯(或4-溴甲苯);
(2)由 D 生成 E 的反应类型为取代反应,E 中官能团的名称为羟基和氯原子;
(3)由 G 生成 H需要将醛基氧化成羧基且不能将碳碳双键氧化,所以,一定条件需要:银氨溶液、加热(或新制氢氧化铜、加热);
(4)B 与 NaOH 溶液在高温、 高压下反应的化学方程式为:
(5)F 酸化后可得 R(C7H6O3),X 能发生银镜反应,即有醛基,且其核磁共振氢谱显示有 3 种不同化学环境的氢,峰面积比为 1∶1∶1,不饱和度仍为5,苯环没有可能了,故其可能的结构为:![]() 、
、 ;
;
(6)由 ![]() 和丙醛合成
和丙醛合成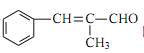 需要加长碳链,引入双键,故设计思路如题目中流程类似:先使其水解成醇,再将其氧化成醛,在此条件下反应
需要加长碳链,引入双键,故设计思路如题目中流程类似:先使其水解成醇,再将其氧化成醛,在此条件下反应![]() ,生成产物。
,生成产物。![]()


 备战中考寒假系列答案
备战中考寒假系列答案科目:高中化学 来源: 题型:
【题目】海水是巨大的资源宝库,海水淡化及其综合利用具有重要意义。
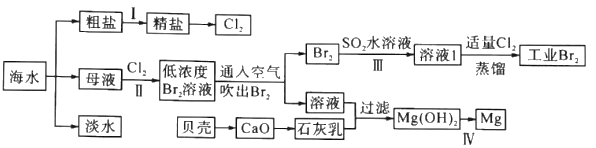
请回答下列问题:
(1)步骤I中,粗盐中含有Ca2+、Mg2+、SO42-等杂质离子,精制时常用的试剂有:①稀盐酸;②氯化钡溶液;③氢氧化钠溶液;④碳酸钠溶液。下列加入试剂的顺序正确的是______(填字母)。
A.①②③④ B.②③④① C.②④③① D.③④②①
请写出加入Na2CO3溶液后相关化学反应的离子方程式:_________、_________。
(2)步骤Ⅱ中已获得Br2,步骤Ⅲ中又将Br2还原为Br-,其目的是_________。步骤Ⅱ用SO2水溶液吸收Br2,吸收率可达95%,有关反应的离子方程式为_________。
(3)为了从工业Br2中提纯溴,除去产物中残留的少量Cl2.可向其中加入_________溶液。
(4)步骤Ⅳ由Mg(OH)2得到单质Mg,以下方法最合适的是_________(填序号)。
A. ![]()
B.![]()
C.![]()
D. ![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某氧化还原反应中有反应物和生成物共六种:NO、FeSO4、Fe(NO3)3、H2O、HNO3和Fe2(SO4)3 . 其中HNO3为反应物,则该反应中的还原剂为( )
A.NO
B.BFeSO4
C.Fe(NO3)3
D.Fe2(SO4)3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】羟胺的电离方程式为: NH2OH+H2O ![]() NH3OH++OH-( 25℃时, Kb=9.0×l0-9)。用 0.l mol·L-1 盐酸滴定 20 mL 0.l mol·L-1 羟胺溶液,恒定 25℃时,滴定过程中由水电离出来的 H+浓度的负对数与盐酸体积的关系如图所示(己知: lg3=0.5)。下列说法正确的是
NH3OH++OH-( 25℃时, Kb=9.0×l0-9)。用 0.l mol·L-1 盐酸滴定 20 mL 0.l mol·L-1 羟胺溶液,恒定 25℃时,滴定过程中由水电离出来的 H+浓度的负对数与盐酸体积的关系如图所示(己知: lg3=0.5)。下列说法正确的是
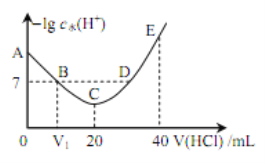
A. 图中 V1>10
B. A 点对应溶液的 pH=9.5
C. B、 D 两点对应的溶液均为中性
D. E 点对应溶液中存在:c(H+)=c (OH-)+c (NH3OH+)+c (NH2OH)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】非金属硼的合金及其化合物有着广泛的用途。
(1)硼钢合金的硬度是普通钢材的 4 倍,其主要成分是铁。 画出基态铁原子的价电子排布图_____。
(2)氨硼烷(NH3BH3)是一种新型储氢材料,其分子中存在配位键, 则氨硼烷分子结构式为_____。写出一种与氨硼烷互为等电子体的分子_____(填化学式)。
(3)常温常压下硼酸(H3BO3)晶体结构为层状,其二维平面结构如右图所示。
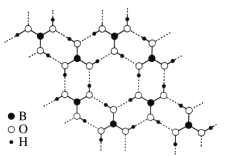
①1 mol H3BO3晶体中含有______mol 氢键。
②请从氢键的角度解释硼酸在冷水中的溶解度小而加热时溶解度增大的原因:__________。
(4)硼氢化钠是一种常用的还原剂。其晶胞结构如右图所示:

①该晶体中Na+的配位数为_____。
②H3BO3 分子中的 O—B—O 的键角_____(填“大于”、“等于”或“小于”) BH4-中的 H—B—H 的键角,判断依据是_____。
③已知硼氢化钠晶体的密度为 ρ g/cm3, NA代表阿伏伽德罗常数的值,则 a=_____(用含 ρ、 NA的代数式表示);④若硼氢化钠晶胞上下底心处的 Na+被 Li+取代,得到的晶体的化学式为_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列三组实验进行一段时间后,溶液中均有白色沉淀生成,下列结论不正确的是
实验① | 实验② | 实验③ |
|
|
|
A. 实验①中生成的沉淀是BaCO3
B. 实验①中有气体生成
C. 实验②沉淀中可能含有BaSO4
D. 实验③生成沉淀的离子方程式是:Ba2++ H2SO3===BaSO3↓+2H+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机玻璃的单体甲基丙烯酸甲酯(MMA) 的合成原理如下:
 (MMA)
(MMA)
下列说法正确的是
A. 若反应①的原子利用率为100%,则物质X为CO2
B. 可用分液漏斗分离MMA和甲醇
C. ![]() 、
、![]() 均可发生加成反应、氧化反应、取代反应
均可发生加成反应、氧化反应、取代反应
D. MMA与H2反应生成Y,能与NaHCO3溶液反应的Y的同分异构体有3种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列电离方程式正确的是( )
A.H2CO32H++CO32﹣
B.NaHSO4=Na ++HSO4﹣
C.NaHCO3=Na++H++CO32﹣
D.NH4Cl=NH4++Cl﹣
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温时,体积均为50mL物质的量浓度均为0.10mol/L的HX、HY、HZ三种弱酸,分别用0.10mol/L的NaOH溶液滴定,滴定曲线如图所示。下列有关说法错误的是
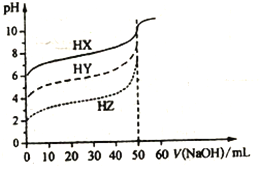
A. 浓度均为0.10mol/L时,酸的电离度:HX<HY<HZ
B. pH均为3.0的三种酸加水稀释至pH均为6.5,加入水的量:HX>HY>HZ
C. 图中当均滴入50mLNaOH溶液时,所得溶液中水的电离程度:HX>HY>HZ
D. 用NaOH溶液中和pH与体积均相等的三种酸时,消耗n(NaOH):HX<HY<HZ
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com