
【题目】图中A至F都是化合物,且A、B、E、F均含钠元素,G为单质,是空气的主要成分之一。
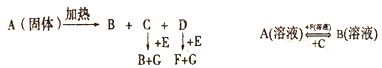
(1)钠离子的结构示意图为__________。含钠元素的物质焰色反应时呈___________。
(2)写出A、B、E、F的化学式:A______;B_______;E______;F______。
【答案】 ![]() 黄色 NaHCO3 Na2CO3 Na2O2 NaOH
黄色 NaHCO3 Na2CO3 Na2O2 NaOH
【解析】试题分析:本题考查无机推断,侧重Na的化合物之间的相互转化。A、B、E、F都是含钠元素的化合物,A受热分解成B、C、D,则A为NaHCO3,B为Na2CO3;A+F→B,B溶液+C→A溶液,C为CO2,F为NaOH,根据NaHCO3受热分解的产物推知D为H2O;C+E→B+G、D+E→F+G,G为单质,是空气的主要成分之一,E为Na2O2,G为O2。
(1)Na+的核电荷数为11,核外有10个电子,Na+的结构示意图为![]() 。含钠元素的物质焰色反应时呈黄色。
。含钠元素的物质焰色反应时呈黄色。
(2)根据上述分析,A、B、E、F的化学式依次为NaHCO3、Na2CO3、Na2O2、NaOH。


 轻松课堂单元期中期末专题冲刺100分系列答案
轻松课堂单元期中期末专题冲刺100分系列答案科目:高中化学 来源: 题型:
【题目】亚硫酸盐是一种常见的食品添加剂,用如图实验可检验某食品中亚硫酸盐含量(含量通常以1kg样品中含SO2的质量计;所加试剂均足量)。下列说法不正确的是
![]()
A. 葡萄酒酿造时通入SO2起到了杀菌和增酸的作用
B. 反应①中若不通入N2则测得的SO2含量偏低
C. 反应①中煮沸的目的是加快亚硫酸的分解,降低SO2的溶解度
D. 若仅将②中的氧化剂“H2O2溶液”替换为“溴水”,对测定结果无影响
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质与其用途相符合的是
①Cl2——做消毒剂 ②AgBr——制胶卷,感光纸 ③AgI——人工降雨
④加碘食盐——预防甲状腺肿大 ⑤淀粉——检验I2的存在 ⑥NaClO——漂白纺织物
A.②③④⑤⑥B.①②③④⑤C.②③④⑤D.全部
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某校探究学习小组用已部分生锈的废铁屑制作印刷电路板的腐蚀剂,并回收铜。探究过程如图所示:

请回答下列问题:
(1)步骤①中先加入热的Na2CO3溶液除油污,操作甲的名称是________。
(2)步骤②中,除发生反应Fe+2HCl===FeCl2+H2↑外,其他可能反应的离子方程式为_______________________________________________________。
(3)溶液C的颜色是________,溶液D中可能含有的金属阳离子有_______________。
(4)可以验证溶液B中是否含有Fe2+的一种试剂是______(填选项序号)。
a.稀硫酸 b.铁c.硫氰化钾 d.酸性高锰酸钾溶液
(5)操作乙的名称是________,步骤⑤产生金属铜的化学方程式为_______________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组微粒中,在一定条件下均可以作氧化剂的是( )
A.Fe、H2O、CO2B.ClO-、Cl-、Ag+
C.Cl2、HClO、MgD.Fe3+、MnO4-、NO3-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于下列反应的说法中正确的是( )
A. 2CuFeS2+O2===Cu2S+2FeS+SO2,CuFeS2是氧化剂,O2是还原剂
B. 3NO2+H2O===2HNO3+NO,氧化产物与还原产物的物质的量之比为2∶1
C. 反应KClO3+6HCl(浓)===KCl+3Cl2↑+3H2O,生成3molCl2,转移电子6mol
D. Cr2O![]() +6Fe2++14H+===2Cr3++6Fe3++7H2O,说明还原性Cr3+> Fe2+
+6Fe2++14H+===2Cr3++6Fe3++7H2O,说明还原性Cr3+> Fe2+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,下列各组离子在指定溶液中一定能大量共存的是
A. 使甲基橙变红色的溶液:Na+、Cu2+、ClO-、Cl-
B. 0.1 mol·L-1 Na2CO3溶液:K+、AlO![]() 、Cl-、SO42-
、Cl-、SO42-
C. 0.1 mol·L-1 (NH4)2Fe(SO4)2溶液中:H+、Al3+、Cl-、NO![]()
D. KW/c(H+)=0.1 mol·L-1的溶液中:Ca2+、NH4+、CH3COO-、HCO![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲基呋喃与氨在高温下反应得到甲基吡咯:
 +H2O
+H2O
(1)Zn的基态原子核外电子排布式为____________。
(2)配合物[Zn(NH3)3(H2O)]2+中,与Zn2+形成配位键的原子是_____________(填元素符号)。
(3)1 mol甲基呋喃分子中含有σ键的数目为_______________mol。
(4)甲基吡咯分子中碳原子轨道的杂化轨道类型是____________。与NH3分子互为等电子体的阳离子为________________。
(5)甲基吡咯的熔沸点高于甲基呋喃的原因是________________。
(6)锌的某种化合物晶胞结构如图所示,则构成该化合物的两种粒子个数比为_____________
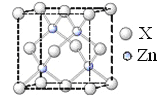
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com