
【题目】下列说法不正确的是
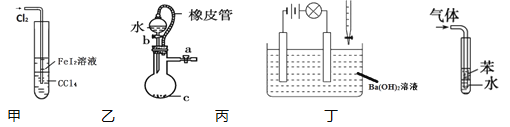
A.甲装置可以用于比较Fe3+ 、I2 、Cl2的氧化性强弱
B.乙装置中橡皮管的作用是使水能顺利流下
C.丙装置中,若向Ba(OH)2溶液中逐滴加入硫酸溶液直至过量,灯光会由亮变暗至熄灭后又逐渐变亮
D.丁装置用于吸收HCl气体能防倒吸
 寒假学与练系列答案
寒假学与练系列答案科目:高中化学 来源: 题型:
【题目】下列有关纯净物、混合物、电解质、非电解质的正确组合为
选项 | 纯净物 | 混合物 | 电解质 | 非电解质 |
A | 纯盐酸 | 淀粉溶液 | 硫酸 | 液氨 |
B | 漂粉精 | 水玻璃 | 氧化铝 | 二氧化硫 |
C | 胆矾 | 氢氧化铁胶体 | 碳酸钠 | 乙醇 |
D | 水银 | 澄清石灰水 | 氯化铜 | 铁 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式书写正确的是( )
A.在100 mL 1 mol·L-1的 Fe(NO3)3的溶液中通入足量SO2:
2Fe3++SO2+2H2O===2Fe2++SO![]() +4H+
+4H+
B.在100 mL 2 mol·L-1的FeI2的溶液中通入标况下5.6 L的Cl2:
4Fe2++6I-+5Cl2===4Fe3++3I2+10Cl-
C.向NaHCO3溶液中加入过量的澄清石灰水:2HCO![]() +Ca2++2OH-===CaCO3↓+2H2O+CO
+Ca2++2OH-===CaCO3↓+2H2O+CO![]()
D.向明矾溶液中加入过量的氢氧化钡溶液:
Al3++2SO![]() +2Ba2++4OH-===2BaSO4↓+AlO
+2Ba2++4OH-===2BaSO4↓+AlO![]() +2H2O
+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁、铜及其化合物在日常生产、生活中有着广泛的应用。回答下列问题:
(1)铁元素在周期表中的位置是_______,基态Cu2+的核外电子排布式是__________。元素铁与铜的第二电离能分别为:ICu=1958 kJ·mol-1、IFe=1561 kJ·mol-1,ICu>IFe的原因是_________________。
(2)有机铁肥三硝酸六尿素合铁(Ⅲ),化学式为:[Fe(H2NCONH2)6](NO3)3。
①尿素分子中C原子的杂化方式是__________。
②[Fe(H2NCONH2)6](NO3)3 中“H2NCONH2”与 Fe(Ⅲ)之间的作用力是_______。根据价层电子对互斥理论推测 NO3-的空间构型为____________。
(3)Fe3+可用SCN-检验,其对应的酸有两种,分别为硫氰酸(H-S-C≡N)和异硫氰酸(H-N=C=S),这两种酸中沸点较高的是_______, 原因是______________。
(4)FeCl3晶体易溶于水和乙醇,用酒精灯加热即可气化,由此可知 FeCl3的晶体类型为______;S和Fe形成的某化合物,其晶胞如图一所示, 则该物质的化学式为__________。

(5)Cu晶体的堆积方式如图二所示,晶体中Cu原子的配位数为_______;设Cu原子半径为a,晶体空间利用率为 _________(用含a 的式子表达,不化简)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应中,熵显著减少的反应是 ( )
A. CO(g)+2H2(g)= CH3OH(g)
B. CaCO3(s)+2HCl(aq)= CaCl2(aq)+CO2(g)+H2O(l)
C. (NH4)2CO3(s)= NH4HCO3(s)+NH3(g)
D. 2HgO(s)= 2Hg(l)+O2(g)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应的离子方程式可用H++OH﹣═H2O表示的是( )
A.醋酸与KOH溶液反应
B.稀硫酸与Ba(OH)2溶液反应
C.NaHSO4溶液与NaOH溶液反应
D.盐酸与氨水反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】表各组变化中,后者一定包括前者的是( )
A | 化学变化 | 物理变化 |
B | 氧化还原反应 | 分解反应 |
C | 氧化还原反应 | 化合反应 |
D | 中和反应 | 复分解反应 |
A.A
B.B
C.C
D.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把1 mol X气体和0.5 mol Y气体混合于2 L密闭容器中,发生如下反应:3X(g)+Y(g)![]() nZ(g)+2W(g),2 min末生成0.4 mol W,若测得以Z的物质的量浓度变化表示的平均反应速率为0.1mol/(L·min) ,试计算(写出计算过程)
nZ(g)+2W(g),2 min末生成0.4 mol W,若测得以Z的物质的量浓度变化表示的平均反应速率为0.1mol/(L·min) ,试计算(写出计算过程)
(1)前2 min内,用X表示的平均反应速率。
(2)2 min末时Y的转化率。
(3)化学方程式中Z的化学计量数n。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(I).常温下0.01mol/L HCl溶液由水电离产生的c(H+)与PH=11的CH3COONa溶液中由水电离产生的c(OH-)之比为________。
(II).实验室中配制AgNO3溶液时通常需要向其中加入硝酸目的是______;AgCl在水中存在沉淀溶解平衡:AgCl(s)![]() Ag+(aq)+Cl-(aq)。25℃时,现将足量AgCl分别放入:①100mL蒸馏水;②100mL 0.2molL-1AgNO3溶液;③100mL 0.1molL-1氯化镁溶液;④100mL 0.1molL-1氯化钠溶液.充分搅拌后,相同温度下Ag+浓度由大到小的顺序是______ (填写序号)。
Ag+(aq)+Cl-(aq)。25℃时,现将足量AgCl分别放入:①100mL蒸馏水;②100mL 0.2molL-1AgNO3溶液;③100mL 0.1molL-1氯化镁溶液;④100mL 0.1molL-1氯化钠溶液.充分搅拌后,相同温度下Ag+浓度由大到小的顺序是______ (填写序号)。
(III).己知醋酸和盐酸是日常生活中极为常见的酸,在一定条件下,CH3COOH溶液中存在电离平衡:CH3COOH![]() CH3COO-+H+ △H>0。
CH3COO-+H+ △H>0。
(1) 25 C时,浓度均为0.lmol/L的盐酸和醋酸溶液,下列说法正确的是__________;
①两溶液的pH相同
②两溶液的导电能力相同
③由水电离出的c(OH-)相同
④中和等物质的量的NaOH溶液,消耗两溶液的体积相同
(2)25℃时,在pH=5的稀醋酸溶液中,c(CH3COO-)=_________(填数字表达式);
(3)25℃时,若向氨水中加入稀盐酸至溶液的pH==7,此时c(NH4 +) =amol/L,则c(Cl-)=__________。
(4)25℃时,向体积为VamL pH=3的醋酸溶液中滴加pH=11的NaOH溶液VbmL至溶液恰好呈中性,则Va与的Vb关系是Va____vb (填“>”、“<”或“=”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com