
分析 体积不变、恒定温度下,气体的体积比等于物质的量比,设A、B的物质的量分别为5n、2n,转化的B为x,则
2A(g)+B(g)?3C(g)
开始 5n 2n 0
转化 2x x 3x
平衡 5n-2x 2n-x 3x
达平衡时混合气体中C的体积分数为60%,则$\frac{3x}{5n-2x+2n-x+3x}$×100%=60%,解得x=1.4n,以此来解答.
解答 解:体积不变、恒定温度下,气体的体积比等于物质的量比,设A、B的物质的量分别为5n、2n,转化的B为x,则
2A(g)+B(g)?3C(g)
开始 5n 2n 0
转化 2x x 3x
平衡 5n-2x 2n-x 3x
达平衡时混合气体中C的体积分数为60%,则$\frac{3x}{5n-2x+2n-x+3x}$×100%=60%,解得x=1.4n,
(1)A的转化率为$\frac{2×1.4n}{5n}$×100%=56%;B的转化率为$\frac{1.4n}{2n}$×100%=70%,故答案为:56%;70%;
(2)由M=$\frac{m}{n}$可知平衡时混合气体的平均相对分子质量为$\frac{5n×a+2n×b}{7n}$=$\frac{5a+2b}{7}$,故答案为:$\frac{5a+2b}{7}$;
(3)该反应为体积不变的反应,反应前后气体的物质的量不变,则平衡时压强与起始时相比,压强不变,故答案为:不变.
点评 本题考查化学平衡的计算,为高频考点,把握化学平衡三段法、体积分数及转化率计算为解答的关键,侧重分析与计算能力的考查,注意反应为体积不变的反应,题目难度不大.


 通城学典默写能手系列答案
通城学典默写能手系列答案 金牌教辅培优优选卷期末冲刺100分系列答案
金牌教辅培优优选卷期末冲刺100分系列答案科目:高中化学 来源: 题型:选择题
| A. | 漂白粉溶液在空气中失效:ClO-+CO2+H2O═HClO+HCO3- | |
| B. | 用FeCl3溶液腐蚀铜板制印刷电路板:2Fe3++Cu═2Fe2++Cu2+ | |
| C. | 向NaAlO2溶液中通入少量CO2制Al(OH)3:AlO2-+CO2+2H2O═HCO3-+Al(OH)3↓ | |
| D. | 碳酸氢铵溶液中加入过量氢氧化钠溶液:HCO3-+OH-═CO32-+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1mol任何物质都含有6.02×1023个分子 | |
| B. | 在相同条件下,相同物质的量CO、N2的混合气体与O2的分子个数相同,原子个数也相同 | |
| C. | NaOH的摩尔质量40g | |
| D. | 在标准状况下,1molO2与1molSO3的体积相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铁与稀硫酸反应:2Fe+6H+=2Fe3++3H2↑ | |
| B. | 碳酸钙与醋酸反应:CaCO3+2H+═Ca2++CO2↑+H2O | |
| C. | 盐酸滴在石灰石上:CO32-+2H+=CO2↑+H2O | |
| D. | 铜片插入硝酸银溶液中:Cu+2Ag+=Cu2++2Ag |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②④ | B. | ②③④ | C. | ①③⑤ | D. | ①②④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铁与盐酸的反应:2Fe+6H +═2Fe 3 ++3 H 2↑ | |
| B. | 碳酸钙溶于醋酸中:CaCO 3+2H +═Ca 2 ++2H 2O+CO 2↑ | |
| C. | 铜片插入硝酸银溶液:Cu+Ag +═Cu 2++Ag | |
| D. | 钠与水反应::2Na+2H 2O═2OH -+2Na ++H 2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
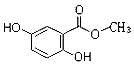
 .
.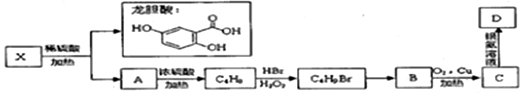
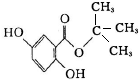 ,C4H9Br→B的化学反应是取代反应.
,C4H9Br→B的化学反应是取代反应. .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 温度(℃) | 30 | 20 | l5 | l0 | 5 | 0 | -2 | -6 |
| FeSO4(g/L) | 240 | 190 | 130 | 117 | 95 | 79 | 59 | 38 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| Al(OH)3 | Ga(OH)3 | |
| 酸式电离常数Ka | 2×10-11 | 1×10-2 |
| 碱式电离常数Kb | 1.3×10-33 | 1.4×10-34 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com