
【题目】二氧化碳的回收利用是环保和能源领域研究的热点课题。
(1)新的研究表明,利用太阳能可以将CO2分解制取炭黑,其原理如右图所示。该过程的能量转化形式为______,在整个过程中,FeO的作用是_________。
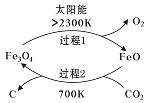
已知:
①2Fe2O4(s)=6FeO(s)+O2(g) ΔH=akJ/mol
②C(s)+O2(g)=CO2(g) ΔH=bKJ/mol 则过程2的热化学方程式为________。
(2)一定温度下,在密闭容器中进行反应CO2(g)+CH4(g)![]() 2CO(g)+2H2(g) ΔH>0,下列说法正确的是________。
2CO(g)+2H2(g) ΔH>0,下列说法正确的是________。
A.当混合气体的平均相对分子质量不变时,反应达到平衡状态
B.升高温度,加快反应速率,CO2的转化率降低
C.增大CO2的浓度,平衡向正反应方向移动,平衡常数增大
D.平衡时CO、H2的体积分数不一定相等
(3)在2L恒容密闭容器中充入2molCO2和nmolH2,在一定条件下发生反应CO2(g)+3H2(g)![]() CH3COOH(g)+H2O(g),CO2的转化率与温度、投料比
CH3COOH(g)+H2O(g),CO2的转化率与温度、投料比![]() 的关系如右图所示。
的关系如右图所示。
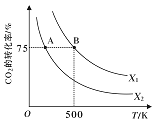
①若从反应开始到A点需要10s,则V(H2)= _____。
②该反应的平衡常数表达式为______,若X1=3,则B点的K=___________。
③根据图像判断X1 ____X2(填“>”、“<”或“=”,下同),平衡常数KA ___KB。
④若在500K时,按X1投料,在恒压下进行,达到平衡状态,此时CO2的转化率______75%(填“>”、“<”或“=”)
(4)美国伊利诺大学芝加哥分校(UIC)的研究团队设计出一种突破性的新太阳能电池,能把大气中的二氧化碳转换成碳氢化合物(hydrocarbon)燃料,解决了现代社会的两大挑战:“减少大气的碳含量”以及“有效率地制造高密度能源”。右图是通过CO2和H2O作用制备CH3OH的原理示意图。
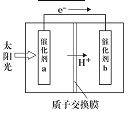
①a电极的名称_________,电极产物___________。
②b电极的电极反应为_________。
【答案】 太阳能转化成化学能 催化剂 6FeO(s)+CO2(g)![]() =2Fe3O4(s)+C(s) ΔH=(-a-b)kJ/mol AD 0.225mol/Ls K=c(CH2OH)·c(H2O)/[c(CO2)·c3(H2)] 5.3 > > > 负极 H+、O2 CO2+6H++6e-=CH3OH+H2O
=2Fe3O4(s)+C(s) ΔH=(-a-b)kJ/mol AD 0.225mol/Ls K=c(CH2OH)·c(H2O)/[c(CO2)·c3(H2)] 5.3 > > > 负极 H+、O2 CO2+6H++6e-=CH3OH+H2O
【解析】(1)从图中可以看出①2Fe2O4(s)=6FeO(s)+O2(g) ΔH=akJ/mol吸收太阳能,转化为化学能,又已知②C(s)+O2(g)=CO2(g) ΔH=bKJ/mol ,由-1×①-②得过程2的热化学方程式为 6FeO(s)+CO2(g)![]() =2Fe3O4(s)+C(s) ΔH=(-a-b)kJ/mol ,从过程1和2中FeO先作反应物,后作生成物,FeO起催化剂的作用;(2)A、CO2(g)+CH4(g)
=2Fe3O4(s)+C(s) ΔH=(-a-b)kJ/mol ,从过程1和2中FeO先作反应物,后作生成物,FeO起催化剂的作用;(2)A、CO2(g)+CH4(g)![]() 2CO(g)+2H2,反应物系数之和不等于生成物系数之和,只要平衡有所移动,势必会导致分子数的变化,所以当混合气体的平均相对分子质量一定,一定是平衡状态,故A正确;B、升高温度,加快反应速率,该反应是吸热反应,平衡正向移动,CO2的转化率升高,故B错误;C、增大CO2的浓度,平衡向正反应方向移动,但温度不变,平衡常数不变,故C错误;D、由于不清楚该反应的开始状态,所以平衡时CO、H2 的体积分数不一定相等,故正确。(3) ①由图像可知,CO2的转化率是0.75,则反应的CO2的物质的量为1.5mol,因此v(CO2)=1.5mol/(2L×10min)=0.075 mol/(L·s),换算成v(H2)= 0.225 mol/(L·s)。
2CO(g)+2H2,反应物系数之和不等于生成物系数之和,只要平衡有所移动,势必会导致分子数的变化,所以当混合气体的平均相对分子质量一定,一定是平衡状态,故A正确;B、升高温度,加快反应速率,该反应是吸热反应,平衡正向移动,CO2的转化率升高,故B错误;C、增大CO2的浓度,平衡向正反应方向移动,但温度不变,平衡常数不变,故C错误;D、由于不清楚该反应的开始状态,所以平衡时CO、H2 的体积分数不一定相等,故正确。(3) ①由图像可知,CO2的转化率是0.75,则反应的CO2的物质的量为1.5mol,因此v(CO2)=1.5mol/(2L×10min)=0.075 mol/(L·s),换算成v(H2)= 0.225 mol/(L·s)。
②若X1=3,则n=6,B 点时C(CH3OH)=C(H2O)=0.75mol·L-1,C(CO2)=0.25mol·L-1,C(H2)=0.75mol·L-1,用三段式进行计算可得出,K=5.3。
③根据图像可知,在等温时,X1 条件下CO2 的转化率大于在X2 条件下CO2 的转化率,说明X1>X2。随温度升高,CO2 的转化率减小,平衡逆向移动,说明正反应是放热的,B 点的温度比A 点高,所以平衡常数KA>KB。
④在500 K 时,恒容下,随反应的进行,压强减小,若在恒压下达到平衡状态,相当于对恒容下进行加压,平衡正向移动,此时CO2 的转化率变大。
(4)该电池的总反应为2CO2+4H2O=2CH3OH+3O2,可以将太阳能转变为化学能;①分析图像,由电子转移的方向可知,a 为负极,发生氧化反应:2H2O―4e―=O2+4H+ ;②b 为正极,发生还原反应:CO2+6H++6e-=CH3OH+H2O


科目:高中化学 来源: 题型:
【题目】某密闭容器中发生如下反应:X(g)+3Y(g)2Z(g)△H<0。如图表示该反应的速率(v)随时间(t)变化的关系,t2、t3、t5时刻外界条件有所改变,但都没有改变各物质的初始加入量。下列说法中正确的是( )

A. t5时增大了压强
B. t3时降低了温度
C. t2时加入了催化剂
D. t4~t5时间内转化率一定最低
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将4 mol A气体和2 mol B气体在2 L固定体积的容器中混合,并在一定条件下发生如下反应∶2A(g)+B(g)![]() 2C(g)。若经2s后测得C的浓度为0.6 mol L-1,现有下列几种说法,其中正确的是
2C(g)。若经2s后测得C的浓度为0.6 mol L-1,现有下列几种说法,其中正确的是
A.用物质A表示的反应的平均速率为0.6 mol (L s)-1
B.2 s时物质B的浓度为1.4 mol L-1
C.2 s时物质A的转化率为70%
D.2 s时物质A的体积分数为![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了除去粗盐中的Ca2+ 、Mg2+ 、SO42-及泥沙,可将粗盐溶于水,然后进行下列五项操作。其正确的顺序是①过滤 ②加过量的NaOH溶液 ③加适量盐酸 ④加过量Na2CO3溶液 ⑤ 加过量BaCl2 溶液
A.①④②⑤③ B.④①②⑤③ C.②⑤④①③ D.②④①③⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有下列物:①乙醇、②苯酚、③乙醛、④丙烯酸(CH2=CHCOOH)、⑤乙酸乙酯。其中与溴水、酸性KMnO4溶液、NaHCO3溶液都能反应的是( )
A. ①③ B. ②⑤ C. ④ D. ③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】离子液体在有机合成、无机合成等方面有着重要应用。咪唑是合成“离子液体”的一种原料,其结构如图所示。下列有关咪唑说法不正确的是
![]()
A. 化学式C3H4N2
B. 分子中含有一种非极性键和两种极性键
C. 可以发生取代、加成、氧化反应
D. 一氯取代物的同分异构体共有4种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】MnO2在工业上具有广泛的用途,例如用作干电池去极剂、合成工业的催化剂和氧化剂,玻璃工业和搪瓷工业的着色剂、消色剂、脱铁剂等。
I.在实验室中,可以用MnO2催化分解H2O2或KClO3制备O2。
(1)设计简单的实验验证MnO2对H2O2的分解起催化作用________。
(2)如果用MnO2催化分解KCIO3制备并收集O2,应选用的实验装置是_______。

若用B装置制备少量的NH3,则a中盛放的药品是_______。
II.MnO2是实验室中常见的氧化剂,某化学兴趣小组探究在常温下,MnO2能否氧化酸性NaI溶液。可选用的试剂和仪器有:0.5mol/LNaI溶液,稀硫酸、稀盐酸、CCl4、酒精、分液漏斗、烧杯、漏斗、玻璃棒、酒精灯、温度计、牛角管、锥形瓶、石棉网、铁架台(带铁圈、铁夹)。
实验的步骤如下:
①在小烧杯中加入15mLNaI溶液,加硫酸使其酸化,加适量的MnO2,充分搅拌。
②将所得溶液过滤,观察滤液颜色。
③向滤液中加入5mL萃取剂,充分振荡。
④置于铁架台铁圈上静置。
⑤分液。
⑥将下层得到的含I2溶液进行蒸馏使得到单质I2。
请回答下列问题:
(1)写出步骤①中发生的离子方程式___________。
(2)观察步骤②所得滤液的颜色为_______,初步判定有单质I2生成。
(3)萃取滤液中的碘单质所用的仪器名称为_______,选择的萃取剂是______。
(4)步骤④静置后,观察到的现象是_______。
(5)简述分液的操作:________。
(6)步骤⑥中组装蒸馏装置还缺少的仪器是___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质存在如下图所示的转化关系(反应条件、部分产物未标出),已知某物质X是一种正盐,E是强酸
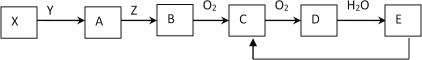
试回答下列问题:
(1)若Y为强酸,且B为黄色固体单质
①从组成物质的元素化合价变化角度预测C可能具有的性质_______________
②一定条件下E转化为C有多种途径,写出其中一种转化的化学反应方程式_______________________。
(2) 若Y为强碱,且B为空气中含量最高的气态单质
①写出实验室制取A的化学方程式______________________________________。
②若A→B的转化常用来检验Z气体管道的是否漏气,用该方法检验的现象是____________________,
其化学反应方程式_________________________________________。
③C、D都是大气污染物,它们对环境造成的危害表现在_______。
A.引起酸雨 B.引起温室效应
C.形成光化学烟雾 D.引起水体富营养化
④将x mL C、y mL D混合于同一试管中,将试管倒置于水中,同时通入z mL O2充分反应后,试管内气体全部消失,则x:y:z不可能是 _______________
A 1:1:1 B 2:1:1
C 3:7:4 D 1:5:2
(3)无论Y为强酸或强碱均符合上述转化,则物质X的化学式_______________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com