
【题目】某研究性学习小组设计了一组实验验证元素周期律. Ⅰ.甲同学设计了如如图装置来一次性完成元素氮、碳、硅非金属性强弱的比较。

(1)甲同学在连接好仪器后,加入药品之前的具体操作是:______________
(2)要证明氮、碳、硅非金属性强弱,在 A 中加________________溶液,B 中加___________溶液,C 中加___________溶液,将观察到C 中________________的现象.但花花认为,该现象不足以证明三者非金属性强弱,请用文字叙述理由_____________。
(3)为避免上述问题,应在 B、C 之间增加一个盛有足量_____的洗气装置.改进后C 中发生反应的离子方程式是________________.
Ⅱ.丙同学设计了如如图装置来验证卤族元素性质的递变规律.A、B、C 三处分别是沾有NaBr 溶液的棉花、湿润淀粉 KI 试纸、湿润红纸.

(4)请写出浓盐酸与高锰酸钾反应的离子方程式:______________
(5)A 中棉花颜色变_______,则说明非金属性 Cl>Br;向 NaBr 和 KI 的混合溶液中,通入足量的 Cl2 充分反应后,将所得溶液蒸干并灼烧,最后得到的物质是___________
【答案】将导管C中导管没于液面下,微热圆底烧瓶 ,有气泡产生,冷却至室温有一段液柱,一段时间后,高度不变,则气密性良好 HNO3 Na2CO3 Na2SiO3 白色浑浊 挥发出的硝酸可能和硅酸钠反应 饱和碳酸氢钠溶液 SiO32-+CO2+H2O═H2SiO3↓+CO32- 2MnO4- +16H+ + 10Cl-=2Mn2++5Cl2↑+8H2O 橙色 NaCl和KCl
【解析】
(1)甲同学在连接好仪器后,加入药品之前,首先关闭分液漏斗,将烧杯C中导管深入烧杯液面以下,再微热圆底烧瓶,如果C中有气泡产生,冷却至室温有一段液柱,一段时间后,高度不变,则气密性良好,故答案为:将导管C中导管没于液面下,微热圆底烧瓶,有气泡产生,冷却至室温有一段液柱,一段时间后,高度不变,则气密性良好。
(2)依据强酸制弱酸来设计反应,所以A为硝酸,B为碳酸钙,C为硅酸钠溶液,将观察到C中有白色浑浊生成硅酸沉淀,故现象不足以证明三者非金属性强弱,因为挥发出来的硝酸可能与硅酸钠反应生成硅酸沉淀,故答案为:HNO3;CaCO3;Na2SiO3;白色浑浊;挥发出的硝酸可能和硅酸钠反应。
(3)硝酸易挥发,避免干扰,所以为吸收挥发出来的硝酸,应在B和C之间增加一个洗气装置,盛放饱和的碳酸氢钠,吸收挥发出来的硝酸,避免干扰,改进后C中为二氧化碳与硅酸钠反应生成硅酸沉淀和碳酸钠,反应的离子方程式是SiO32-+CO2+H2O=H2SiO3↓+CO32-,:故答案为:饱和碳酸氢钠溶液;SiO32-+CO2+H2O=H2SiO3↓+CO32-。
(4)浓盐酸与高锰酸钾发生氧化还原反应,生成氯气、氯化锰、氯化钾和水,反应的离子方程式为:2MnO4-+16H+ +10Cl-=2Mn2++5Cl2↑+8H2O,故答案为:2MnO4-+16H+ +10Cl-=2Mn2++5Cl2↑+8H2O。
(5)NaBr溶液的棉花与氯气反应生成单质溴,所以棉花由白色变为橙色,B处湿润淀粉KI试纸中的碘离子与氯气反应生成单质碘,反应的离子方程式为:2I-+Cl2=2Cl-+I2;向NaBr和KI的混合溶液中,通入足量的Cl2充分反应后,将所得溶液蒸干并灼烧,过量的氯气逸出,溴挥发,碘升华,所以最后得到NaCl和KCl;故答案为:橙色;NaCl和KCl。


科目:高中化学 来源: 题型:
【题目】已知:H2(g)+F2(g)===2HF(g) ΔH=-270 kJ/mol,下列说法正确的是( )
A.氟化氢气体分解生成氢气和氟气的反应是放热反应
B.1 mol H2与1 mol F2反应生成2 mol液态HF放出的热量小于270 kJ
C.在相同条件下,1 mol H2与1 mol F2的能量总和大于2 mol HF气体的能量
D.该反应中的能量变化可用如图来表示
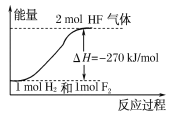
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质与酸反应产生CO2的反应速率最大的是( )
选项 | 温度 | 物质 | 酸 |
A | 25 ℃ | 石灰石粒 | 0.1 mol·L-1 盐酸 |
B | 25 ℃ | 石灰石粒 | 0.1 mol·L-1 硫酸 |
C | 50 ℃ | 石灰石粒 | 0.1 mol·L-1 盐酸 |
D | 50 ℃ | 石灰石粉 | 0.1 mol·L-1 硫酸 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组离子中,能在无色透明的强酸性溶液里大量共存的是
A.MnO4-、K+、Na+、SO42-B.Na+、K+、HCO3-、Cl-
C.Mg2+、NH4+、NO3-、Cl-D.Cu2+、K+、OH-、SO42-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国科学家屠呦呦因创造性地研制出抗疟新药青蒿素和双氢青蒿素(对疟原虫有100%的抑制率)而获2015年诺贝尔医学奖。如图为青蒿素的键线式,以下关于青蒿素的说法错误的是

A. 含有酯基,可水解
B. 含有过氧键,有较强氧化性,且不够稳定
C. 青蒿素的化学式C15 H24O5
D. 在水中溶解度不大,易溶于有机溶剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于浓硝酸的说法不正确的是
A. 光照易分解
B. 露置于空气中溶液浓度降低
C. 能与碳反应说明其具有强氧化性
D. 常温下铜在浓硝酸中发生钝化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铜的化合物有很多,用途很广。如磷化铜(Cu3P2)用于制造磷青铜,磷青铜是含少量锡、磷的铜合金,主要用作耐磨零件和弹性原件。
(1)基态锡原子的价电子排布式为_________,据此推测,锡的最常见正价是_________ 。
(2)磷化铜与水反应产生有毒的磷化氢(PH3),PH3分子的中心原子的杂化方式是_________ 。
(3)磷青铜中的锡、磷两种元素电负性的大小为Sn____P(填“>”“<”或“=”)。
(4)比较S、P的第一电离能I1(S)____I1(P)(填“>”“<”或“=”)。某磷青铜晶胞结构如下图所示:

(5)该晶体中P原子位于_______空隙中。
(6)若晶体密度为ag/cm3,P与最近的Cu原子核间距为______pm(用含NA的代数式表示)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com