
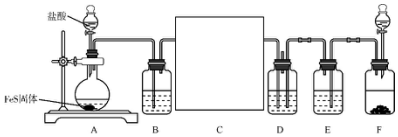

分析 A装置由盐酸与FeS制备硫化氢气体,其中混有氯化氢和水蒸气,B装置中盛放饱和食盐水吸收氯化氢,C装置应为干燥装置,F中由亚硫酸钠与浓硫酸制备二氧化硫气体,E为干燥装置,干燥的H2S和SO2在D装置中混合反应,2H2S+SO2=3S↓+2H2O,硫化氢与二氧化硫气体污染空气,不能直接排放,需要尾气处理,据此分析解答.
解答 解:(1)F中为浓硫酸与亚硫酸钠反应制备二氧化硫,反应为:Na2SO3+H2SO4═SO2↑+Na2SO4+H2O;
故答案为:Na2SO3+H2SO4═SO2↑+Na2SO4+H2O;
(2)B为吸收氯化氢的装置,应为饱和食盐水,E为干燥二氧化硫的装置,应为浓硫酸;
故答案为:饱和食盐水;浓硫酸;
(3)C为干燥硫化氢气体的干燥装置,硫化氢用酸性或中性干燥剂,但浓硫酸与硫化氢反应反应,故不能用浓硫酸干燥,可选用氯化钙干燥,装置为: ;
;
故答案为: ;
;
(4)D中的反应为:2H2S+SO2=3S↓+2H2O,能看到淡黄色沉淀生成;
故答案为:有淡黄色沉淀生成;
(5)硫化氢与二氧化硫气体污染空气,不能直接排放,需要尾气处理,故可在D装置加一个盛放碱石灰的干燥管;
故答案为:D装置加一个盛放碱石灰的干燥管.
点评 本题考查了物质制备过程分析判断,物质性质的理解应用,化学方程式书写,掌握基础是关键,题目难度中等.


科目:高中化学 来源:2016-2017学年四川省成都市高一上10月月考化学试卷(解析版) 题型:选择题
以NA代表阿伏加德罗常数,下列说法正确的是
A.在标准状况下,NA 个H2O 分子所占体积约为22.4L
B.0.1 mol H2、0.2 mol O2、0.3 mol N2和0.4 mol CO2组成的混合气体在标准状况下的体积约为22.4 L
C.常温常压下, 2.24 L CO和CO2混合气体中含有的碳原子数目为0.1 NA
D.0.5mol/L的NaCl溶液中Cl—的个数为是0.5NA
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | KOH(aq)+$\frac{1}{2}$H2SO4(aq)═$\frac{1}{2}$K2SO4(aq)+H2O(l)△H=-11.46 kJ/mol | |
| B. | 2KOH(aq)+H2SO4(aq)═K2SO4(aq)+2H2O(l)△H=-11.46 kJ/mol | |
| C. | 2KOH(aq)+H2SO4(aq)═K2SO4(aq)+2H2O(l)△H=-114.6 kJ/mol | |
| D. | KOH(aq)+$\frac{1}{2}$H2SO4(aq)═$\frac{1}{2}$K2SO4(aq)+H2O(l)△H=-57.3 kJ/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 6种 | B. | 12种 | C. | 18种 | D. | 24种 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 酸雨是指pH值小于7的天然降水 | |
| B. | 酸雨中的主要溶质是SO2 | |
| C. | 酸雨的形成过程中不可能出现SO3 | |
| D. | 工业上大量燃烧含硫燃料是酸雨的成因 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 溶液中$\frac{c(M{g}^{2+})}{c(M{n}^{2+})}$=$\frac{1}{100}$ | |
| B. | 若加入少量NaOH,Ksp[Mg(OH)2]和Ksp[Mn(OH)2]均减小 | |
| C. | 若加入少量MgCl2,溶液中c(Mg2+)和c(Mn2+)均增大 | |
| D. | 若升高温度,Mg(OH)2和Mn(OH)2两种固体的质量均不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Ge(32号元素)的单晶可以作为光电转换材料用于太阳能电池 | |
| B. | 交警检查司机是否酒后驾车的原理中体现了乙醇的还原性 | |
| C. | 在家用电热水器不锈钢内胆镶嵌镁棒,以防止内胆被腐蚀 | |
| D. | 施用适量石灰乳可降低盐碱地(含较多NaCl、Na2CO3)的碱性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| X | Y | Z |
| W |
| A. | Z元素的常见化合价为:-1、-2 | |
| B. | X元素的氢化物的沸点一定比Z的低 | |
| C. | Y、Z、W形成的简单离子中,半径最小的是Z | |
| D. | Z元素的单质能从Na2W溶液中置换出W的单质 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com