
 Na2S2O3(aq)
Na2S2O3(aq)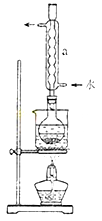
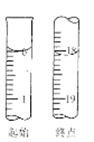




 黄冈冠军课课练系列答案
黄冈冠军课课练系列答案科目:高中化学 来源:不详 题型:单选题
| 选项 | 待提纯的物质 | 选用的试剂 | 操作方法 |
| A | NaOH(Na2CO3) | 盐酸 | - |
| B | CO2(CO) | CuO | 加热 |
| C | Fe(Al) | 稀硫酸 | 过滤 |
| D | CO2(HCl) | Na2CO3溶液 | 洗气 |
| A.A | B.B | C.C | D.D |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| 编号 | 实验目的 | 实验设计 |
| A | 除去CO2中少量的SO2 | 将混合气体通过饱和Na2CO3溶液 |
| B | 除去Cu粉中混有的CuO | 向混合物中滴加适量稀硝酸 |
| C | 检验溶液中是否含有Fe2+ | 向溶液中滴入氯水后,再滴加KSCN溶液 |
| D | 证明H2CO3酸性比H2SiO3强 | 将CO2通入Na2SiO3溶液中 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 、SO32—、SO42—、Fe2+、Fe3+、K+,按如下流程进行实验:
、SO32—、SO42—、Fe2+、Fe3+、K+,按如下流程进行实验:
| A.现象3不能证明X中是否含有SO42— |
| B.现象2气体C中至少有一种是CO2或SO2,操作Ⅰ为过滤 |
C.现象5表明X溶液中一定含有Cl |
| D.现象1表明X溶液显酸性,沉淀D为Fe(OH)3 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
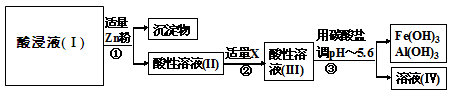
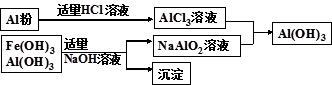
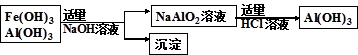
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.通过浓硫酸除去HCl中的H2O | B.通过灼热的CuO除去H2中的CO |
| C.通过灼热的镁粉除去N2中的O2 | D.通过水除去CO中的CO2 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
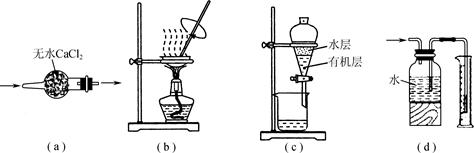
| A.用图a所示装置干燥SO2气体 |
| B.用图b所示装置蒸发CH3COONa溶液得醋酸钠晶体 |
| C.用图c所示装置分离有机层与水层,水层从分液漏斗下口放出 |
| D.用图d所示装置测量氯气的体积 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.用溴水鉴别苯和正已烷 |
| B.用BaCl2溶液鉴别SO42﹣与SO32﹣ |
| C.用浓HNO3与Cu反应制备NO2 |
| D.将混有HCl的Cl2通入饱和NaHCO3溶液中除去HCl |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.某溶液中加入硝酸银溶液,产生白色沉淀,该溶液中一定含有Cl- |
| B.某溶液中加入氢氧化钠溶液立即有白色沉淀产生,该溶液中一定有Al3+ |
| C.某溶液中加入稀盐酸,产生使澄清石灰水变浑浊的气体,该溶液中一定含有CO32- |
| D.某溶液中加入稀盐酸无现象,加入氯化钡溶液有白色溶液产生,该溶液中一定有SO42- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com