
【题目】中学化学中的一些常见物质有如图转化关系(部分产物未给出).其中A、H的焰色呈黄色,D常温下为黄绿色气体,反应③为侯氏制碱法反应原理之一,E是常见的金属.
回答下列问题.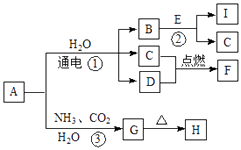
(1)D的电子式为 .
(2)H的化学式为
(3)写出反应①的化学方程式 .
(4)写出反应②的离子方程式 .
【答案】
(1)![]()
(2)Na2CO3
(3)2NaCl+2H2O ![]() 2NaOH+Cl2↑+H2↑
2NaOH+Cl2↑+H2↑
(4)2Al+2OH﹣+2H2O═2AlO2﹣+3H2↑
【解析】解:D气体在常温下呈黄绿色,则D为Cl2 , A、G的焰色反应为黄色,含有Na元素,反应③为侯氏制碱法反应原理之一,则A为NaCl,G为NaHCO3 , H为Na2CO3 , 电解氯化钠溶液生成氢气、氯气与氢氧化钠,E是常见金属,与B反应达到C与I,则E为Al、B为NaOH、C为H2 , I为NaAlO2 , F为HCl,(1)D为氯气,电子式为 ![]() ,故答案为:
,故答案为: ![]() ;(2)H的化学式为:Na2CO3 , 故答案为:Na2CO3;(3)反应①的化学方程式:2NaCl+2H2O
;(2)H的化学式为:Na2CO3 , 故答案为:Na2CO3;(3)反应①的化学方程式:2NaCl+2H2O ![]() 2NaOH+Cl2↑+H2↑,故答案为:2NaCl+2H2O
2NaOH+Cl2↑+H2↑,故答案为:2NaCl+2H2O ![]() 2NaOH+Cl2↑+H2↑;(4)反应②的离子方程式:2Al+2OH﹣+2H2O═2AlO2﹣+3H2↑,故答案为:2Al+2OH﹣+2H2O═2AlO2﹣+3H2↑.
2NaOH+Cl2↑+H2↑;(4)反应②的离子方程式:2Al+2OH﹣+2H2O═2AlO2﹣+3H2↑,故答案为:2Al+2OH﹣+2H2O═2AlO2﹣+3H2↑.
D气体在常温下呈黄绿色,则D为Cl2 , A、G的焰色反应为黄色,含有Na元素,反应③为侯氏制碱法反应原理之一,则A为NaCl,G为NaHCO3 , H为Na2CO3 , 电解氯化钠溶液生成氢气、氯气与氢氧化钠,E是常见金属,与B反应达到C与I,则E为Al、B为NaOH、C为H2 , I为NaAlO2 , F为HCl.


 课时掌控随堂练习系列答案
课时掌控随堂练习系列答案 一课一练一本通系列答案
一课一练一本通系列答案 浙江之星学业水平测试系列答案
浙江之星学业水平测试系列答案科目:高中化学 来源: 题型:
【题目】进行化学实验必须注意安全,下列说法中正确的组合是( )
①点燃氢气前要检验氢气的纯度,以免发生爆炸 ②CO气体有毒,处理CO气体时可将其点燃,转化为无毒的CO2 ③在盛O2的集气瓶中进行铁丝燃烧实验时,事先在集气瓶底部铺上一层沙子 ④用氢气还原氧化铜时,先加热再通入氢气,以免浪费氢气 ⑤稀释浓硫酸的操作如下图所示
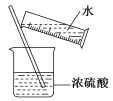
A.①②③④ B.①②③ C.①②④ D.①②③④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如下图所示的甲、乙、丙三种晶体:

试写出:
(1)甲晶体的化学式(X为阳离子)为________。
(2)乙晶体中A、B、C三种粒子的个数比是________。
(3)丙晶体中每个D周围结合E的个数是________个。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在给定条件下,下列选项所示的物质均能实现的是( )
A.Fe ![]() Fe2O3
Fe2O3 ![]() Fe2(SO4)3
Fe2(SO4)3
B.N2 ![]() NO2
NO2 ![]() HNO3
HNO3
C.S ![]() SO2
SO2 ![]() H2SO4
H2SO4
D.AgNO3(aq) ![]() Ag(NH3)2OH(aq)
Ag(NH3)2OH(aq) ![]() Ag
Ag
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用钛白工业的副产品FeSO4[含Al2(SO4)3和少量重金属离子],可以生产电池级高纯超微细草酸亚铁.其工艺流程如图1: 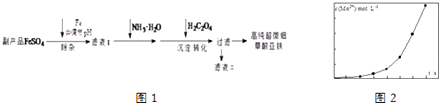
已知:①5Fe2++MnO ![]() +8H+═5Fe3++Mn2++4H2O
+8H+═5Fe3++Mn2++4H2O
②5C2O42﹣+2MnO ![]() +16H+═10CO2↑+2Mn2++8H2O
+16H+═10CO2↑+2Mn2++8H2O
(1)沉淀过程的反应温度为40℃,温度不宜过高的原因除了控制沉淀的粒径外,还有 .
(2)滤液Ⅱ经处理可得到副产品 .
(3)实验室测定高纯超微细草酸亚铁组成的步骤依次为:
步骤1:准确称量一定量草酸亚铁样品,加入25mL 2molL﹣1的H2SO4溶解.
步骤2:用0.2000molL﹣1标准KMnO4溶液滴定,消耗其体积30.40mL.
步骤3:向滴定后的溶液中加入2g Zn粉和5mL 2molL﹣1的H2SO4溶液,将Fe3+还原为Fe2+ .
步骤4:过滤,滤液用上述标准KMnO4溶液滴定,消耗溶液10.40mL.
则样品中C2O42﹣的物质的量为 .
(4)将一定量高锰酸钾溶液与酸化的草酸亚铁溶液混合,测得反应液中Mn2+的浓度随反应时间t的变化如图2,产生这种变化趋势的原因可能为
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA代表阿伏加德罗常数的值。下列说法正确的是
A.18gD2O中含有的中子数为10NA
B.常温常压下,49氦气中所含原子数为2NA
C.标准状况下,22.4LCH3CI中含C-H键数为3NA
D.1L0.3mol/LNH4NO3中所含NH4+数为0.3NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢氧化镁是一种用途广泛、极具开发前景的环保材料,广泛应用在阻燃、废水中和、烟气脱硫等方面.镁硅酸盐矿石(主要成分Mg3Si2O5(OH)4 , 含氧化铝、氧化铁、氧化亚铁等杂质)可用于生产氢氧化镁,简要工艺流程如图1: 
已知:几种金属阳离子的氢氧化物沉淀时的pH如下表所示:
Fe3+ | Al3+ | Fe2+ | Mg2+ | |
开始沉淀时 | 1.5 | 3.3 | 6.5 | 9.4 |
沉淀完全时 | 3.7 | 5.2 | 9.7 | 12.4 |
(1)对矿石焙烧的目的是 .
(2)加入H2O2溶液反应的离子方程式是 .
(3)向溶液Ⅰ中加入的X可以是 , 作用是 .
(4)加入氨水时,Mg2+转化率随温度t的变化如图2所示: ①溶液Ⅱ中发生反应的离子方程式是 .
②t1前Mg2+转化率增大的原因是;
t1后Mg2+转化率下降的原因是(用化学方程式表示) .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,下列各组溶液混合后,溶液一定呈中性的是( )
A.等体积、等物质的量浓度的氨水与盐酸混合
B.pH之和为14的氨水与硝酸等体积混合
C.pH之和为14的Ba(OH)2溶液与NaHSO4溶液等体积混合
D.等体积、等物质的量浓度的Ca(OH)2溶液与Na2CO3溶液混合
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图分别是A,B两种物质的核磁共振氢谱,已知A,B两种物质都是烃类,都含有6个氢原子,试根据两种物质的核磁共振氢谱推测A,B有可能是下面的( ) 
A.A是C3H6 , B是C6H6
B.A是C2H6 , B是C3H6
C.A是C2H6 , B是C6H6
D.A是C3H6 , B是C2H6
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com