
硝酸大量用于制造无机肥料,如硝酸铵、硝酸钙、硝酸磷肥,还广泛用于其他工业生产。硝酸工业生产流程图如下图所示: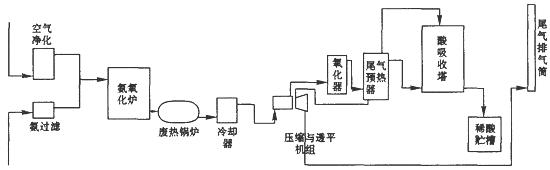
(1)第—步是氨的接触氧化,在一定温度下以铂铑网作为催化剂,写出该反应的化学方程式 。
(2)在吸收塔中用水循环吸收NO2得到硝酸,写出发生该反应的化学方程式 ,该过程是放热的,为了使吸收效果更好,在吸收过程中需要控制在 条件下。
(3)尾气中含有氮的氧化物,直接排放到空气中会危害环境,写出一项氮的氧化物可能引起的环境问题 。工业上常用纯碱溶液吸收NO2,生成亚硝酸盐、硝酸盐和其他物质,写出该反应的化学方程式 。
(1)4NH3+5O2 4NO+6H2O(2分)
4NO+6H2O(2分)
(2)3NO2+H2O=2HNO3+NO(2分) 低温高压(1分)
(3)光化学烟雾、酸雨、破坏臭氧层等合理答案(1分)
2 NO2+Na2CO3= NaNO3 +NaNO2+ CO2(2分)
解析试题分析:(1)氨气的催化氧化,反应方程式是:4NH3+5O2 4NO+6H2O;(2)二氧化氮与水反应的化学方程式是:3NO2+H2O=2HNO3+NO; 该反应是放热,低温促进反应正向移 动,正反应气体体积减小,增大压强,反应正向移动,所以使吸收效果更好在吸收过程中需要控制低温高压下;故答案为:3NO2+H2O=2HNO3+NO;低温高压;
4NO+6H2O;(2)二氧化氮与水反应的化学方程式是:3NO2+H2O=2HNO3+NO; 该反应是放热,低温促进反应正向移 动,正反应气体体积减小,增大压强,反应正向移动,所以使吸收效果更好在吸收过程中需要控制低温高压下;故答案为:3NO2+H2O=2HNO3+NO;低温高压;
(3)一氧化氮能够引起光化学烟雾、酸雨、破坏臭氧层等,严重破坏环境;纯碱和二氧化氮反应,生成亚硝酸盐、硝酸盐,根据化合价升降相等,配平反应的方程式,2NO2+Na2CO3=NaNO3+NaNO2+CO2;
故答案为:光化学烟雾、酸雨、破坏臭氧层等;2NO2+Na2CO3=NaNO3+NaNO2+CO2.
考点:考查工业制取硝酸的原理及尾气的处理.


 计算高手系列答案
计算高手系列答案科目:高中化学 来源: 题型:填空题
【化学-选修2化学与技术】(15分)
如图是现今常规生产发烟硫酸和硫酸的流程图:
(1)在④处二氧化硫被氧化成三氧化硫,④的设备名称是 .该处发生反应的方程式为 .为提高三氧化硫的产率,该处应采用 (填“等温过程”或“绝热过程”)为宜.
(2)在⑦处进行二次催化处理的原因是 .
(3)⑤处气体混合物主要是氮气和三氧化硫.此时气体经过⑥后不立即进入⑦是因为: .
(4)20%的发烟硫酸(SO3的质量分数为20%)1吨需加水 吨(保留2位有效数字)才能配制成98%的成品硫酸.
(5)在②处发生1500℃的“不完全燃烧”,即先混入少量干燥空气,然后在③处于700℃下再继续燃烧.试简述这种燃烧方式对环境保护是有利的原因 .
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
石膏也可用于工业生产二氧化硫,进而生产硫酸。天然石膏的化学式为CaSO4·2H2O。将天然石膏脱水后,第2步化学反应就可制得二氧化硫。
(1)写出第1步反应的化学方程式__________________________________。
(2)在第2步化学反应中,下列原料可以使用的是(用序号填空)__________。写出有关化学反应的方程式_______________________________
①空气 ②氧气 ③硫酸 ④焦炭
(3)在第2步化学反应中,可能会排入空气的气态污染物是________。它(或它们)的主要危害是______________________________
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(1)下列关于工业生产说法正确的是 。(填序号)
| A.在侯氏制碱工业中,向饱和氯化钠溶液中先通二氧化碳,后通氨气 |
| B.在硫酸工业、合成氨工业、硝酸工业中,皆采用循环操作提高原料利用率 |
| C.在氯碱工业,电解槽被离子交换膜隔成阴极室和阳极室 |
| D.工业上采用电解熔融氯化铝的方法制取金属铝 |
| pH | Ca2+ 、Mg2+总浓度 | 细菌总数 |
| 6.5~8.5 | < 0.004 5 mol·L-1? | <100个·mL-1? |

查看答案和解析>>
科目:高中化学 来源: 题型:问答题
(12分)【化学——化学与技术】合成氨工业、硝酸工业、硫酸工业是化学工业的重要组成部分。请回答下列问题:
(1)右图是工业制硫酸的流程示意图: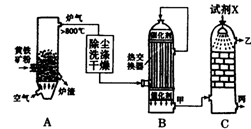
①设备A的名称为 。
②试剂X为 。
③B设备中热交换器的作用是 。
(2)工业制硝酸时,酸吸收塔中的水吸收NO2是放热反应,为使NO2更好被吸收,可采取措施是 ;工业上用Na2 CO3溶液吸收NO2的化学方程式为 。
(3)工业合成氨的化学方程式为 ,选择天然气做为合成氨原料气的优点是 。
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
【化学与技术】
工业上制取硝酸铵的流程图如下,请回答下列问题:
(1)在上述工业制硝酸的生产中,B设备的名称是 ,其中发生反应的化学方程式为 。
(2)此生产过程中,N2与H2合成NH3所用的催化剂是 。1909年化学家哈伯在实验室首次合成了氨,2007年化学家格哈德·埃特尔在哈伯研究所证实了氢气与氮气在固体催化剂表面合成氨的反应过程,示意图如下:
 分别表示N2、H2、NH3。图⑤表示生成的NH3离开催化剂表面,图②和③的含义分别是 、 。
分别表示N2、H2、NH3。图⑤表示生成的NH3离开催化剂表面,图②和③的含义分别是 、 。
(3)在合成氨的设备(合成塔)中,设置热交换器的目的是 ;在合成硝酸的吸收塔中通入空气的目的是 。
(4)生产硝酸的过程中常会产生一些氮的氧化物,可用如下两种方法处理:
碱液吸收法:NO+NO2+2NaOH=2NaNO2+H2O
NH3还原法:8NH3+6NO2催化剂△ 7N2+12H2O(NO也有类似的反应)
以上两种方法中,符合绿色化学的是 。
(5)某化肥厂用NH3制备NH4NO3。已知:由NH3制NO的产率是96%、NO制HNO3的产率是92%,则制HNO3所用去的NH3的质量占总耗NH3质量(不考虑其它损耗)的 %。
(6)硝酸铵是一种常用的氮肥,在贮存和使用该化肥时,应注意的事项及理由是:
| | 注意事项 | 理由 |
| ① | | |
| ② | | |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列叙述中,不符合化学史事实的是( )
| A.法国化学家拉瓦锡建立燃烧现象的氧化学说使近代化学取得了革命性进展 |
| B.英国化学家在世界上首次合成了具有生物活性的蛋白质-------牛胰岛素 |
| C.以碳及其化合物为原料制成的芯片和光导纤维引领我们进入了信息时代 |
| D.经过化学家们的不断努力,从自然界中发现以及人工制造出的化合物已经超过3500万种 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.2FeCl3+Cu=2FeCl2+CuCl2 | ||||
| B.SO3+H2O=H2SO4 | ||||
| C.2FeCl3+2HI=2FeCl2+2HCl+I2 | ||||
D.Cu+Cl2
|
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列化学肥料属于复合肥料的是 ( )
| A.KH2PO4和NH4Cl | B.NH4Cl和NH4NO3 |
| C.KNO3和KH2PO4 | D.NH4Cl和KNO3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com