
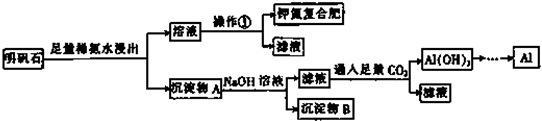
分析 含有Al2O3和少量的Fe2O3等杂质,加足量的稀氨水,明矾石中的铝离子与氨水反应,过滤后沉淀A中含Al2O3、Fe2O3、Al(OH)3,溶液中含钾离子、硫酸根离子,则操作1为蒸发结晶得到硫酸钾晶体,然后结合溶液配制及焰色反应检验钾元素来解答,
(1)明矾石加入足量的稀氨水中浸出时铝离子会和氨水之间反应生成氢氧化铝;
(2)Al2O3和Fe2O3、Al(OH)3都和氨水之间不反应;
(3)溶液蒸发浓缩、冷却结晶、过滤可以得到其晶体物质;
(4)①配制480mL溶液,应选择500mL容量瓶;②根据洗涤仪器的方法来进行;③根据c=$\frac{n}{V}$来确定引起的误差;
(5)确定钾氮复合肥中含有钾元素的方法是焰色反应;
解答 解:含有Al2O3和少量的Fe2O3等杂质,加足量的稀氨水,明矾石中的铝离子与氨水反应,过滤后沉淀A中含Al2O3、Fe2O3、Al(OH)3,溶液中含钾离子、硫酸根离子,则操作1为蒸发结晶得到硫酸钾晶体,
(1)明矾石加入足量的稀氨水中浸出时发生反应的离子方程式为Al3++3NH3.H2O=Al(OH)3↓+3NH4+,
故答案为:Al3++3NH3.H2O=Al(OH)3↓+3NH4+;
(2)杂质均不溶于氨水,铝离子与氨水反应生成沉淀,沉淀A中含Al2O3、Fe2O3、Al(OH)3,
故答案为:Al2O3;Al(OH)3;
(3)由上述分析可知,操作1为蒸发浓缩,
故答案为:蒸发浓缩;
(4)①由溶质的物质的量不变可知,V=$\frac{75×2}{14}$=14.3mL,配制75mL,应选择100mL容量瓶,
故答案为:14.3;100mL容量瓶;
②定容操作为:向容量瓶中缓慢加蒸馏水至离刻度线1~2cm处,改用胶头滴管滴加蒸馏水至凹液面与刻度线相切,
故答案为:向容量瓶中缓慢加蒸馏水至离刻度线1~2cm处,改用胶头滴管滴加蒸馏水至凹液面与刻度线相切;
③A.用量筒量取浓氨水后,未用蒸馏水洗涤量筒并转移至容量瓶中,溶质减少,浓度偏小,故A选;
B.洗涤后的容量瓶中有少量蒸馏水,对实验无影响,故B不选;
C.定容时观察液面俯视,溶液体积偏小,浓度偏大,故C不选;
D.定容摇匀后,发现液面下降,继续加水至刻度线,体积偏大,浓度偏小,故D选;
故答案为:AD;
(5)确定钾氮复合肥中含有钾元素的方法是焰色反应,透过蓝色钴玻璃观察到紫色火焰,则含钾元素,
故答案为:焰色反应,透过蓝色钴玻璃观察到紫色火焰,则含钾元素.
点评 本题考查较综合,涉及物质制备实验方案的设计及溶液配制,把握实验流程中发生的反应及分离方法为解答的关键,侧重分析能力及迁移应用能力的考查,题目难度中等.


 千里马走向假期期末仿真试卷寒假系列答案
千里马走向假期期末仿真试卷寒假系列答案科目:高中化学 来源: 题型:选择题
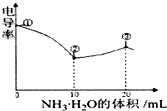 电导率可用于衡量电解质溶液导电能力大小.室温下,用0.100mol•L-lNH3•H2O滴定 10.00mL浓度均为 0.100mol•L-l HCl和CH3COOH的混合溶液,所得曲线如图所示.下列说法正确的是( )
电导率可用于衡量电解质溶液导电能力大小.室温下,用0.100mol•L-lNH3•H2O滴定 10.00mL浓度均为 0.100mol•L-l HCl和CH3COOH的混合溶液,所得曲线如图所示.下列说法正确的是( )| A. | ①点溶液中c (H+)为0.200 mol•L-l | |
| B. | 若反应容器与外界没有热交换,反应后溶液温度高低为①>③>② | |
| C. | pH的大小为:③>②>①,且③点溶液中有c(Cl-)>c(CH3COO-) | |
| D. | ③点后因离子数目减少使溶液电导率略降低 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | KSCN | B. | BaCl2 | C. | NaOH | D. | HCl |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 尽量购买本地的、当季的食物 | |
| B. | 用双氧水代替高锰酸钾制氧气 | |
| C. | 用溴水代替碘水进行萃取实验 | |
| D. | 用铜粉代替铜丝进行Cu与浓HNO3的反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
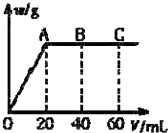 有H2SO4和HCl 的混合溶液20mL,加入0.025mol•L-1 Ba(OH)2溶液时,生成沉淀的质量w(g)和Ba(OH)2溶液的体积V(mL)的关系如图所示(C 点混合液pH=7).
有H2SO4和HCl 的混合溶液20mL,加入0.025mol•L-1 Ba(OH)2溶液时,生成沉淀的质量w(g)和Ba(OH)2溶液的体积V(mL)的关系如图所示(C 点混合液pH=7).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 族 周期 | IA | IIA | IIIA | IVA | VA | VIA | VIIA |
| 2 | a | b | c | ||||
| 3 | d | e | f | g | h | i |
| A. | ①②④ | B. | ②③⑤ | C. | ②④⑤ | D. | ①③⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甲=丙>乙 | B. | 丙>乙>甲 | C. | 乙>丙>甲 | D. | 甲=乙=丙 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com