
【题目】在强酸性的透明溶液中,下列离子组能够大量共存的是( )
A.Na+、K+、OH-、Cl-B.Mg2+、Cu2+、SO42-、Cl-
C.K+、Ba2+、Cl-、HCO3-D.NH4+、Ba2+、Fe3+、SO42-
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】下列离子方程式的书写正确的是( )
A.大理石与盐酸反应:CO32﹣+2H+=CO2↑+H2O
B.铜和硝酸银溶液反应:Cu+Ag+=Cu2++Ag
C.氯气溶于水:Cl2+H2O═2H++Cl﹣+ClO﹣
D.硫酸与氢氧化钡溶液反应:2H++SO42﹣+Ba2++2OH﹣=BaSO4↓+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
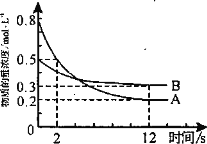
【题目】在容积为1.00L的容器中,通入一定量的N2O4,发生反应N2O4(g)2NO2(g),随温度的升高,混合气体的颜色变深。回答下列问题:
(1)反应的△H___0(填“大于”或“小于”);100℃时,体系中各物质浓度随时间变化如图所示。在0~60s时段,反应速率v(N2O4)为___molL﹣1s﹣1。

(2)100℃时达平衡后,改变反应温度为T,c(N2O4)以0.0020molL﹣1s﹣1的平均速率降低,经10s又达到平衡。T___100℃(填“大于”或“小于”),判断理由是_______________________。
(3)温度T时反应达平衡后,将反应容器的容积减少一半,平衡向___(填“正反应”或“逆反应”)方向移动。
(4)在2NO2N2O4的可逆反应中,下列状态一定属于平衡状态的是(____)
A.N2O4和NO2的分子数比为1:2 B.N2O4和NO2的浓度相等
C.平衡体系的颜色一定不再改变D.单位时间有1molN2O4变为NO2的同时,有2molNO2变为N2O4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碲被誉为“现代工业、国防与尖端技术的维生素”,工业上常用铜阳极泥(主要成分是Cu2Te,含Ag、Au等杂质)为原料提取碲并回收金属其工艺流程如下:
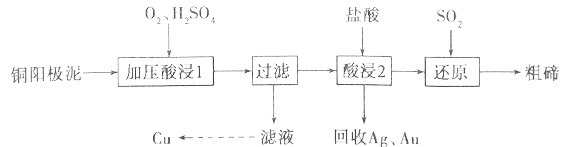
已知:TeO2是两性氧化物,微溶于水,易溶于较浓的强酸和强碱。回答下列问题:
(1)“加压酸浸1”过程中将碲元素转化成TeO2,应控制溶液的pH为4.5~5.0,酸度不能过高,原因是__________________________,其中“加压”的目的是______________________。写出“加压酸浸1”过程中Cu2Te发生反应的化学方程式_________________________________。
(2)“酸浸2”时温度过高会使碲的浸出率降低,原因为______________________。要从Ag和Au中分离出Au,可以向回收的Ag和Au中加入的试剂是______________________。
(3)写出“还原”反应中发生的离子方程式_________________________________。
(4)工业上另一种提取碲的方法是将铜阳极泥在空气中焙烧,使碲转化成TeO2,再加NaOH碱浸,以石墨为电极电解溶液获得Te。电解过程中阴极的电极反应式为_________________________________。
(5)25℃时,向1mol/L的Na2TeO3溶液中滴加盐酸,当溶液pH值约为6时,此时溶液中c(TeO32-):c(HTeO3-)=___________(已知:H2TeO3的Ka1=1.0×10-3,Ka2=2.0×10-8)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式正确的是 ( )
A.用CH3COOH溶解CaCO3:CaCO3+2H+═Ca2++H2O+CO2↑
B.溴化亚铁溶液中通入足量氯气:2Fe2++2Br-+2Cl2=2Fe3+Br2+4Cl-
C.硫酸氢钠溶液中滴加 Ba(OH)2 至溶液刚好呈中性:Ba2++OH-+H++SO42ˉ=BaSO4↓+H2O
D.电解饱和食盐水 2Cl—+ 2H2O![]() H2 ↑+ Cl2 ↑+ 2OH—
H2 ↑+ Cl2 ↑+ 2OH—
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,在2L恒容密闭容器中投入一定量的A、B发生反应:3A(g)+bB(g)![]() cC(g) H=-QkJ·mol-1(Q>0),12s时生成C的物质的量为0.8mol(反应进程如图所示)。下列说法中正确的是
cC(g) H=-QkJ·mol-1(Q>0),12s时生成C的物质的量为0.8mol(反应进程如图所示)。下列说法中正确的是
A. 2s时,A的反应速率为0.15mol·L-1·s-1
B. 图中交点时A的消耗速率等于A的生成速率
C. 化学计量数之比b ∶c = 1∶2
D. 12s内反应放出0.2QkJ热量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向100mL FeI2溶液中逐渐通入C12,其中n(I2)、n(Fe3+)随通入n(C12)的变化如图所示,下列说法不正确的是

A. 氧化性强弱:I2<Fe3+
B. n(Cl2)=0.12mol时,溶液中的离子主要有Fe2+、Fe3+、Clˉ
C. 由图可知,该FeI2溶液的浓度为1mol· L-l
D. n(C12):n(FeI2)=1:2时,反应的离子方程式为:2Fe2++Cl2=2Fe3++2Cl-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】H2和I2在一定条件下能发生反应:H2(g) + I2(g)![]() 2HI(g) ΔH=-a kJ·mol-1
2HI(g) ΔH=-a kJ·mol-1
已知: (a、b、c均大于零)
(a、b、c均大于零)
下列说法不正确的是( )
A. 反应物的总能量高于生成物的总能量
B. 断开1 mol H-H键和1 mol I-I键所需能量大于断开2 mol H-I键所需能量
C. 断开2 mol H-I键所需能量约为(c+b+a) kJ
D. 向密闭容器中加入2 mol H2和2 mol I2,充分反应后放出的热量小于2a kJ
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com