
【题目】磷精矿湿法制备磷酸的一种工艺流程如下:

已知:磷精矿主要成分:Ca5(PO4)3(OH),还含有Ca5(PO4)3F和有机碳等。
(1)上述流程中所采取的实验措施能加快反应速率有_____________。
(2)酸浸时,磷精矿中Ca5(PO4)3(OH)与H2SO4反应的化学方程式为_____________。
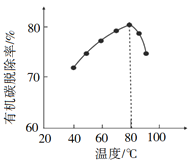
(3)H2O2将粗磷酸中的有机碳氧化为CO2脱除,同时自身也会发生分解。相同投料比、相同反应时间,不同温度下的有机碳脱除率如图所示。80℃后脱除率变化的原因______。
(4)脱硫时,CaCO3稍过量,充分反应后仍有SO42-残留,加入BaCO3代替CaCO3可进一步提高硫的脱除率,原因是_____。向粗磷酸中加入BaCO3脱硫,发生反应的离子方程式是_____。
(5)取ag所得精制磷酸,加适量水稀释,以百里香酚酞作指示剂,用b mol·L-1 NaOH 溶液滴定至终点时生成Na2HPO4,消耗NaOH溶液c L,精制磷酸中H3PO4的质量分数是_____。(已知摩尔质量为98g·mol-1)
【答案】研磨和加热 2Ca5(PO4)3(OH)+10H2SO4+3H2O![]() 6H3PO4+10CaSO4·0.5H2O 80℃后,H2O2分解速率增大,过氧化氢的浓度显著降低 CaSO4微溶于水,BaSO4难溶于水 BaCO3+SO42-+2H3PO4=BaSO4+CO2↑+2H2PO4-
6H3PO4+10CaSO4·0.5H2O 80℃后,H2O2分解速率增大,过氧化氢的浓度显著降低 CaSO4微溶于水,BaSO4难溶于水 BaCO3+SO42-+2H3PO4=BaSO4+CO2↑+2H2PO4- ![]()
【解析】
(1)根据工艺流程,能加快反应速率的是研磨和加热;
(2)根据流程图,酸浸时生成粗磷酸,即生成磷酸,以及还有磷石膏,发生的反应有:![]() ;
;
(3)H2O2不稳定,受热易分解,80℃后脱除率降低,是因为H2O2分解速率增大,过氧化氢的浓度显著降低;
(4)脱硫后,碳酸钙转化成CaSO4,CaSO4微溶于水,溶液中仍有部分SO42-的残留,用BaCO3代替CaCO3,转化成BaSO4,BaSO4难溶于水,这样可以提高硫的脱除率;磷酸为中强酸,且体系中有磷酸的存在,发生离子反应为BaCO3+SO42-+2H3PO4=BaSO4+CO2↑+2H2PO4-;
(5)发生的反应:H3PO4+2NaOH=Na2HPO4+2H2O,磷酸的物质的量为![]() ,其质量为
,其质量为![]() ,H3PO4的质量分数是
,H3PO4的质量分数是![]() 。
。


科目:高中化学 来源: 题型:
【题目】关于Na2CO3 与NaHCO3的性质判断正确的是![]()
![]()
A.常温下溶解度:Na2CO3<NaHCO3
B.热稳定性:Na2CO3<NaHCO3
C.与同浓度盐酸反应的剧烈程度:Na2CO3>NaHCO3
D.与澄清石灰水反应,均有白色沉淀生成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在给定条件下,下列选项所示的物质间转化均能实现的是( )
A.N2(g)![]() NO(g)
NO(g)![]() NO2(g)
NO2(g)
B.SiO2(s)![]() SiCl4(s)
SiCl4(s)![]() Si(s)
Si(s)
C.Al2O3(s)![]() NaAlO2(aq)
NaAlO2(aq)![]() Al(OH)3(s)
Al(OH)3(s)
D.FeO(s)![]() Fe(NO3)3(aq)
Fe(NO3)3(aq)![]() Fe(s)
Fe(s)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】![]() 为阿伏加德罗常数的值。下列说法正确的是
为阿伏加德罗常数的值。下列说法正确的是
A. 0.1 mol 的![]() 中,含有
中,含有![]() 个中子
个中子
B. pH=1的H3PO4溶液中,含有![]() 个
个![]()
C. 2.24L(标准状况)苯在O2中完全燃烧,得到![]() 个CO2分子
个CO2分子
D. 密闭容器中1 mol PCl3与1 mol Cl2反应制备 PCl5(g),增加![]() 个P-Cl键
个P-Cl键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NaClO溶液是一种纺织工业用漂白剂,可用一定比例NaOH、Na2CO3的混合溶液和Cl2反应制备。
(1)NaHCO3的存在能增强NaClO溶液的稳定性。Cl2与混合溶液中Na2CO3反应制备NaClO,同时生成NaHCO3,其化学方程式为___。
(2)NaClO溶液中若含有NaClO3会影响产品的品质。测定碱性NaClO样品中NaClO3物质的量浓度的方法如下:取20.00mLNaClO溶液试样,加入过量H2O2,充分反应后,加热煮沸,冷却至室温,加入硫酸酸化,再加入0.1000mol·L-1FeSO4标准溶液30.00mL,充分反应后,用0.01000mol·L-1酸性K2Cr2O7溶液滴定过量的FeSO4溶液至终点(Cr2O72-被还原为Cr3+),消耗该溶液25.00mL。
已知:ClO3-在碱性条件下性质稳定,在酸性条件下表现出强氧化性;ClO3-+Fe2++H+—Cl-+Fe3++H2O(未配平)。
①加入过量H2O2的目的是__。
②实验中若缺少加热煮沸步骤,所测NaClO3物质的量浓度会有较大误差,原因可能是___(答出一个即可)。
③计算样品中NaClO3物质的量浓度___(写出计算过程)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应中,氧化反应与还原反应在同一元素间进行的是
A.Cl2 + 2NaOH = NaCl + NaClO + H2O
B.Fe + CuSO4 = FeSO4 + Cu
C.2KClO3 ![]() 2KCl + 3O2↑
2KCl + 3O2↑
D.2H2O ![]() 2H2↑+ O2↑
2H2↑+ O2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,HNO2和CH3COOH的电离常数分別为5.0×10-4和1.7×10-5。将pH和体积均相同的两种酸溶液分别稀释,其pH随加水体积的变化如图所示。下列叙述正确的是
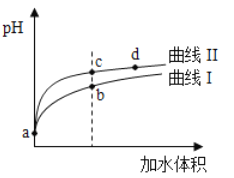
A.曲线I代表HNO2溶液
B.溶液中水的电离程度:b点>c点
C.相同体积a点的两溶液分别与NaOH恰好中和后,溶液中n(Na+)相同
D.从c点到d点,溶液中![]() 保持不变(其中HA、A-分别代表相应的酸和酸根离子)
保持不变(其中HA、A-分别代表相应的酸和酸根离子)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,下列各组离子在指定溶液中一定能大量共存的是()
A.1.0 mol·L-1的KNO3溶液:H+,Fe2+,Cl-,![]()
B.石蕊溶液呈红色的溶液:![]() ,Ba2+,
,Ba2+,![]() ,Cl-
,Cl-
C.pH=12的溶液:K+,Na+,CH3COO-,Br-
D.与铝反应产生大量氢气的溶液:Na+,K+,![]() ,
,![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com