
分析 (1)根据c(H+)=$\sqrt{K•c(C{H}_{3}COOH)}$计算;
(2)带有玻璃活塞的仪器在使用前要检验是否漏水;
(3)到达滴定终点时,溶液由酸性变为弱碱性;
(4)根据c(待测)=$\frac{c(标准)×V(标准)}{V(待测)}$分析不当操作对相关物理量的影响,以此判断浓度的误差.
解答 解:(1)c(H+)=$\sqrt{K•c(C{H}_{3}COOH)}$=$\sqrt{1.6×1{0}^{-5}×0.01}$mol/L=4×10-4mol/L,pH=-lg4×10-4≈3.4;
故答案为:4×10-4;3.4;
(2)带有玻璃活塞的仪器在使用前要检验是否漏水,所以滴定管在使用前除洗涤外,还应检查是否漏液;
故答案为:检查是否漏液;
(3)向20mL 0.01mol•L-1 CH3COOH溶液中逐滴加入0.01mol•L-1 KOH溶液,开始滴定时,溶液显酸性,到达滴定终点时,溶液由酸性变为弱碱性,酚酞由无色变为浅红色;
故答案为:溶液由无色变为浅红色,且在半分钟内不褪色;
(4)A.碱式滴定管未用标准碱液润洗就直接注入标准液,则标准溶液的浓度偏小,消耗的标准溶液的体积偏大,则所测CH3COOH溶液的浓度偏高,故A不选;
B.读取碱液体积时,开始仰视读数,滴定结束时俯视读数,则标准溶液的体积偏小,则所测CH3COOH溶液的浓度偏低,故B选;
C.碱式滴定管在滴定前有气泡,滴定后气泡消失,消耗的标准溶液的体积偏大,则所测CH3COOH溶液的浓度偏高,故C不选;
D.滴定前盛放CH3COOH溶液的锥形瓶用蒸馏水洗净后没有干燥,对滴定结果无影响,故D不选;
故答案为:B.
点评 本题考查了弱电解质的电离和pH的计算、中和滴定误差分析,题目难度不大,注意中和滴定时锥形瓶不能润洗,滴定管必须润洗,注意操作的规范性和掌握实验中常见的误差分析技巧.


 精英口算卡系列答案
精英口算卡系列答案 应用题点拨系列答案
应用题点拨系列答案 状元及第系列答案
状元及第系列答案 同步奥数系列答案
同步奥数系列答案科目:高中化学 来源:2016-2017学年天津市高一上9月调研化学试卷(解析版) 题型:填空题
(易混易错题组)有关物质的量浓度的计算
(1)将4gNaOH固体溶于水配成250mL溶液,此溶液中NaOH的物质的量浓度为_________mol/L。取出10mL此溶液,其中含有NaOH_________g。将取出的溶液加水稀释到100mL,稀释后溶液中NaOH的物质的量浓度为_________mol/L。

(2)如图实验室某浓盐酸试剂瓶标签上的有关数据,据此计算:该浓盐酸中HCl的物质的量浓度为__________mol/L;用上述浓盐酸和蒸馏水配制500 mL物质的量浓度为0.400 mol/L的稀盐酸。需要量取___________mL上述浓盐酸进行配制。
(3)100mL0.3mol/LNa2SO4溶液和50mL0.2mol/LAl2(SO4)3溶液混合后,溶液中SO42-的物质的量浓度为__________mol/L
(4)标准状况下,将V L A气体(摩尔质量为M g/mol)溶于0.1L水(密度1 g/cm3)中,所得溶液的密度为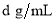 ,则此溶液的物质的量浓度为 mol/L
,则此溶液的物质的量浓度为 mol/L
A. B.
B. C.
C. D.
D.
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
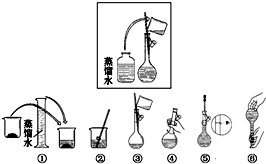 某同学帮助水质检测站配制480mL0.5mol•L-1NaOH溶液.
某同学帮助水质检测站配制480mL0.5mol•L-1NaOH溶液.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2NA个HCl分子与44.8 L H2和Cl2的混合气体所含的原子数目均为4NA | |
| B. | 32gCu将足量浓、稀硝酸分别还原为NO2和NO,浓、稀硝酸得到的电子数均为NA | |
| C. | 物质的量浓度均为1mol/L的NaCl和MgCl2混合溶液中,含有Cl-的数目为3NA | |
| D. | 1molD3${\;}_{\;}^{18}$O+(其中D代表${\;}_{1}^{2}$H)中含有的中子数为10NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 其溶液中的c(OH-)=0.1mol•L-1 | |
| B. | 加水稀释后,水电离出的c(OH-)变大 | |
| C. | 加水稀释后,溶液中c(NH4+)•c(OH-)变大 | |
| D. | 与AlCl3溶液发生反应的离子方程式为:Al3++3OH-═Al(OH)3↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
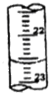 某学生用0.1000mol/L盐酸标准溶液测定某烧碱样品的纯度(杂质不与盐酸反应).实验步骤如下:
某学生用0.1000mol/L盐酸标准溶液测定某烧碱样品的纯度(杂质不与盐酸反应).实验步骤如下:| 滴定次数 | 待测液体积 | 标准盐酸体积(mL) | |
| 滴定前读数(mL) | 滴定后读数(mL) | ||
| 第一次 | 20.00 | 0.20 | 20.38 |
| 第二次 | 20.00 | 4.00 | 24.20 |
| 第三次 | 20.00 | 2.38 | a |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | AgI悬浊液中存在平衡:AgI(s)?Ag+(aq)+I-(aq) | |
| B. | 25℃时,向AgCl的悬浊液中加入NaCl固体,AgCl的溶度积常数不变 | |
| C. | 向含KCl、NaI的混合溶液中滴入AgNO3溶液,一定先析出AgI沉淀 | |
| D. | 用等体积的水和氯化钠溶液分别洗涤AgCl沉淀,水洗造成的AgCl损耗大 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com