
| A. | c(OH-)前者大于后者 | |
| B. | 与同浓度的盐酸反应时的反应速率前者大于后者 | |
| C. | 分别加入1L的0.2 mol/L的HNO3 后一定产生4.48LCO2 | |
| D. | 溶液中阳离子浓度相同 |
分析 A、CO32-的水解程度远远大于HCO3-水解程度;水解规律:谁强显谁性;
B、碳酸氢钠可以和盐酸直接反应得到二氧化碳气体,但是碳酸钠和盐酸反应先是转化为碳酸氢根离子,然后放出二氧化碳;
C、分别加入1L的0.2 mol/L的HNO3后,碳酸氢钠可以和酸直接反应得到二氧化碳气体,但是碳酸钠和酸反应先是转化为碳酸氢根离子,然后放出二氧化碳,据此计算;
D、碳酸根离子的水解程度大于碳酸氢根离子的水解程度,据此回答.
解答 解:A、CO32-的水解程度远远大于HCO3-水解程度,二者水解均显碱性,根据水解规律:谁强显谁性,所以Na2CO3中的氢氧根浓度大于NaHCO3溶液中的氢氧根浓度,故A错误;
B、碳酸氢钠可以和盐酸直接反应得到二氧化碳气体,但是碳酸钠和盐酸反应先是转化为碳酸氢根离子,然后放出二氧化碳,所以浓度均为0.2mol/L的NaHCO3和Na2CO3溶液与同浓度的盐酸反应时的反应速率前者大于后者,故B正确;
C、浓度均为0.2mol/L的NaHCO3和Na2CO3溶液,分别加入1L的0.2 mol/L的HNO3后,产生二氧化碳的量取决于碳酸钠、碳酸氢钠的浓度以及体积的大小,故C错误;
D、碳酸根离子的水解程度大于碳酸氢根离子的水解程度,所以碳酸钠中氢离子浓度小于碳酸氢钠中氢离子浓度,二者的溶液中钠离子浓度是一样的,所以溶液中阳离子浓度是碳酸氢钠溶液中更大,故D错误.
故选B.
点评 本题考查盐的水解的应用,明确水解原理及盐类水解规律的应用是解题的关键,难度不大.


 夺冠金卷全能练考系列答案
夺冠金卷全能练考系列答案科目:高中化学 来源: 题型:选择题
| A. | 2.25mol/L | B. | 2mol/L | C. | 4mol/L | D. | 0.6mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 相同温度下两种溶液的pH:Na2CO3>NaHCO3 | |
| B. | 若分别升高温度,两种溶液的pH均减小 | |
| C. | 若分别加入少量NaOH,两溶液中c(CO32-)均增大 | |
| D. | 两溶液中的离子浓度均存在关系:c(Na+)+c(H+)=c(OH-)+c(HCO3-)+2c(CO32-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 二氧化硅不与任何酸反应,可用石英制造耐酸容器 | |
| B. | 二氧化氯具有还原性,可用于自来水的杀菌消毒 | |
| C. | 常温下浓硫酸使铝钝化,可在常温下用铝制贮罐贮运浓硫酸 | |
| D. | 二氧化氮溶于水时只生成唯一产物硝酸,工业上利用这一原理生产硝酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
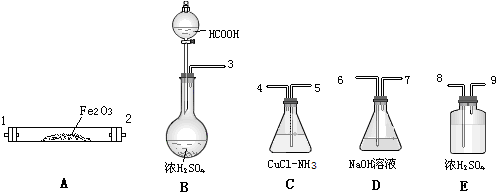
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
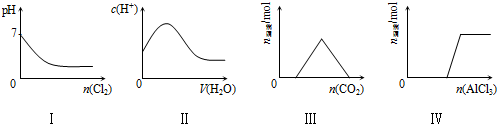
| A. | I表示向Na2SO3溶液中通入Cl2 | |
| B. | II表示向纯CH3COOH中逐滴加水并不断振荡 | |
| C. | III表示向KOH和Ca(OH)2混合液中通入CO2 | |
| D. | Ⅳ表示向NaOH溶液中逐滴加入AlCl3溶液并不断振荡 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
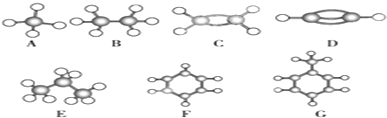
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com