

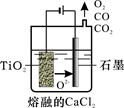
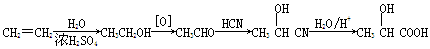
 H4TiO4+2H+;将溶液中的Fe3+还原为Fe2+,消耗溶液中的H+促进TiO2+水解(2)TiO2+4e-==Ti+2O2-(3)Fe2++2HCO3-==FeCO3↓+CO2↑+H2O;(NH4)2SO4(4)防止Fe2+被空气中的氧气氧化(5)165.9
H4TiO4+2H+;将溶液中的Fe3+还原为Fe2+,消耗溶液中的H+促进TiO2+水解(2)TiO2+4e-==Ti+2O2-(3)Fe2++2HCO3-==FeCO3↓+CO2↑+H2O;(NH4)2SO4(4)防止Fe2+被空气中的氧气氧化(5)165.9 H4TiO4+2H+;将溶液中的Fe3+还原为Fe2+,消耗溶液中的H+促进TiO2+水解(2)电解时,阴极上得电子发生还原反应,所以二氧化钛得电子生成钛和氧离子,故阴极电极反应:TiO2+4e-==Ti+2O2-(3)NH4HCO3在溶液中电离出HCO3-离子,易电离生成碳酸根,碳酸根和亚铁离子反应生成FeCO3促进HCO3-电离,故离子方程式Fe2++2HCO3-==FeCO3↓+CO2↑+H2O;所得的副产物为溶液中没有参加反应的铵根离子和硫酸根离子形成的(NH4)2SO4;(4)亚铁离子易被氧气氧化,所以步骤⑥必须控制一定的真空度,这样有利于蒸发水还能防止Fe2+被氧化;(5)由题意知,乳酸生成乳酸亚铁的摩尔比为2:1,设需要乙烯x m3,则反应生成468kg乳酸亚铁晶体所需乙烯为
H4TiO4+2H+;将溶液中的Fe3+还原为Fe2+,消耗溶液中的H+促进TiO2+水解(2)电解时,阴极上得电子发生还原反应,所以二氧化钛得电子生成钛和氧离子,故阴极电极反应:TiO2+4e-==Ti+2O2-(3)NH4HCO3在溶液中电离出HCO3-离子,易电离生成碳酸根,碳酸根和亚铁离子反应生成FeCO3促进HCO3-电离,故离子方程式Fe2++2HCO3-==FeCO3↓+CO2↑+H2O;所得的副产物为溶液中没有参加反应的铵根离子和硫酸根离子形成的(NH4)2SO4;(4)亚铁离子易被氧气氧化,所以步骤⑥必须控制一定的真空度,这样有利于蒸发水还能防止Fe2+被氧化;(5)由题意知,乳酸生成乳酸亚铁的摩尔比为2:1,设需要乙烯x m3,则反应生成468kg乳酸亚铁晶体所需乙烯为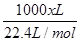 ×0.6×0.9×2=
×0.6×0.9×2=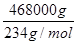 ,x="165.9" m3。
,x="165.9" m3。

科目:高中化学 来源:不详 题型:填空题
 4CuSO4+2Fe2(SO4)3+2H2O。某工厂运用该原理生产铜和绿矾的工艺如下:
4CuSO4+2Fe2(SO4)3+2H2O。某工厂运用该原理生产铜和绿矾的工艺如下:
| A.Cu; | B.Cu2(OH)2CO3; | C.H2SO4; | D.Fe;E.CuO |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
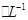 ,则此溶液最多能溶解铁粉的质量为
,则此溶液最多能溶解铁粉的质量为| A.5.6g | B.11.2 g | C.22.4g | D.33.6g |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
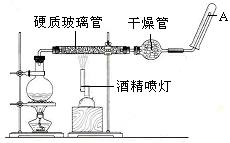
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
| 编号 | 实践操作 | 实验主要现象 | 离子方程式 |
| ① | 加入过量铁粉 | | |
| ② | 加入少量Na2O2粉末 | | |
| ③ | 加入少量AgNO3溶液 | | |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
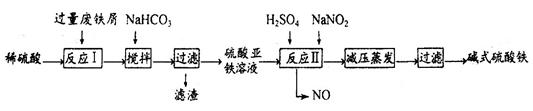
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Al(OH)3 |
| 开始沉淀 | 2.3 | 7.5 | 3.4 |
| 完全沉淀 | 3.2 | 9.7 | 4.4 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 3Fe+4CO2,若有1.5 mol Fe3O4参加反应,转移电子的物质的量是 。
3Fe+4CO2,若有1.5 mol Fe3O4参加反应,转移电子的物质的量是 。| | 陈述Ⅰ | 陈述Ⅱ | 判断 |
| A | 铁是地壳中含量最高的金属元素 | 铁是人类最早使用的金属材料 | Ⅰ对;Ⅱ对;有 |
| B | 常温下铁与稀硫酸反应生成氢气 | 一定温度下氢气能还原氧化铁得到铁 | Ⅰ对;Ⅱ对;无 |
| C | 铁属于过渡元素 | 铁和铁的某些化合物可用作催化剂 | Ⅰ错;Ⅱ对;无 |
| D | 在空气中铁表面形成致密氧化膜 | 铁不能与氧气反应 | Ⅰ对;Ⅱ对;有 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.1.12g | B.6.42g | C.2.24g | D.3.24g |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.直接加碱,调整溶液pH≥9.6 |
| B.加纯铜粉,将Fe2+还原出来 |
| C.先将Fe2+氧化成Fe3+,再调整pH在3~4 |
| D.通入硫化氢,使Fe2+直接沉淀 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com