
| 25℃平衡体系(苯、水、HA) | 平衡常数 | 焓变 | 起始总浓度 |
| 在水中,HA?H++A- | K1 | △H1 | 3.0×10-3 mol?L-1 |
| 在苯中,2HA?(HA)2 | K2 | △H2 | 4.0×10-3 mol?L-1 |
| c[(HA)2] |
| c2(HA) |
| 5 |
| 9 |

| c[(HA)2] |
| c2(HA) |
| 6.0×10-4×(6.0×10-4) |
| 2.4×10-3 |
| 1.6×10-3mol/L |
| 4.0×10-3mol/L |
1.6×10-3×
| ||
| (2.4×10-3)2 |
| c[(HA)2] |
| c2(HA) |
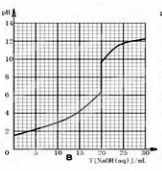 ,
, .
.


科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、K+、HCO3-、CO32-、Br- |
| B、CO32-、HCO3-、OH-、K+ |
| C、Fe3+、Cu2+、NO3-、SO42- |
| D、H+、Cl-、Na+、SO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、pH为2的溶液中:K+、Mg2+、I-、ClO- |
| B、Br-不能大量存在的溶液中:Fe2+、Ca2+、Cl-、NO3- |
| C、(NH4)2Fe(SO4)2?6H2O溶液中:Na+、Cu2+、Cl-、H+ |
| D、NaH2PO4的溶液中:NH4+、K+、HS-、CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:
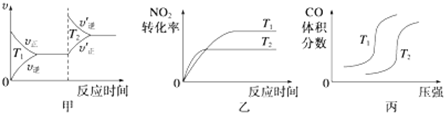
| 起始物质的量 | 甲 | 乙 | 丙 |
| n(H2O)/mol | 0.10 | 0.20 | 0.20 |
| n(CO)/mol | 0.10 | 0.10 | 0.20 |
查看答案和解析>>
科目:高中化学 来源: 题型:
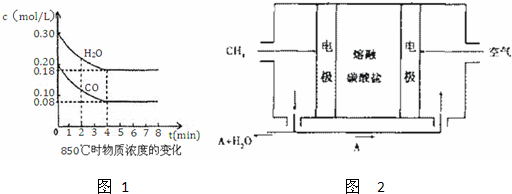
| 1 |
| 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
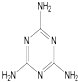 ,关于它的下列说法正确的是
,关于它的下列说法正确的是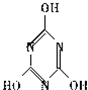 ).三聚氰酸可看成是三分子氰酸通过加成反应得到的环状分子,则氰酸的结构式是
).三聚氰酸可看成是三分子氰酸通过加成反应得到的环状分子,则氰酸的结构式是查看答案和解析>>
科目:高中化学 来源: 题型:
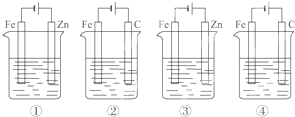
| A、④②③① | B、④③②① |
| C、④③①② | D、④①③② |
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com