
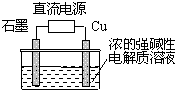
 Cu2O是一种半导体材料,制取Cu2O的电解池如图,总反应为:2Cu+H2O$\frac{\underline{\;通电\;}}{\;}$Cu2O+H2↑.下列说法不正确的是( )
Cu2O是一种半导体材料,制取Cu2O的电解池如图,总反应为:2Cu+H2O$\frac{\underline{\;通电\;}}{\;}$Cu2O+H2↑.下列说法不正确的是( )| A. | 铜电极发生氧化反应 | |
| B. | 铜电极接直流电源的负极 | |
| C. | 石墨电极上产生氢气 | |
| D. | 每生成1molCu2O时,就有2mol电子转移 |
分析 根据电解总反应为2Cu+H2O═Cu2O+H2↑可以知道金属铜为阳极材料,在阳极发生失电子的氧化反应,在阴极上是氢离子发生的电子的还原反应.
解答 解:A、电解总反应:2Cu+H2O═Cu2O+H2↑,铜电极本身失电子,发生氧化反应,故A正确;
B、电解总反应:2Cu+H2O═Cu2O+H2↑,金属铜失电子,说明金属铜一定作阳极,接直流电源的正极,故B错误;
C、电解总反应:2Cu+H2O═Cu2O+H2↑,金属铜失电子,说明金属铜一定作阳极,石墨做阴极,在阴极上是溶液中的氢离子得电子,产生氢气,故C正确;
D、反应2Cu+H2O═Cu2O+H2↑失电子的量为2mol,生成氧化亚铜1mol,所以生成1molCu2O时,就有2mol电子转移,故D正确.
故选B.
点评 本题考查学生电解池的工作原理,注意阴阳极的判断及电极反应式的书写,要求学生熟记教材知识,并会灵活运用,题目难度不大.


科目:高中化学 来源: 题型:解答题
| 元素 | 结构或性质信息 |
| A | 其原子最外层电子数是内层电子数的2倍 |
| B | 基态原子最外层电子排布为nSnnPn+1 |
| C | 非金属元素,其单质为固体,在氧气中燃烧时有明亮的蓝紫色火焰 |
| D | 单质在常温、常压下是气体.基态原子的M层上有1个未成对的P电子 |
| E | 其与A形成的合金为目的用量最多的金属材料 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 操作及现象 | 解释 | |
| A | 鸡蛋白溶液中分别加入NaCl溶液和HgCl2溶液,均有固体析出 | 蛋白质发生了变性 |
| B | 盛放浓NaOH溶液的试剂瓶用玻璃塞久置后,瓶塞很难打开 | NaOH腐蚀玻璃,生成的硅酸钠将瓶口与瓶塞粘在一起 |
| C | 配制FeCl3溶液时加入适量盐酸酸化 | 抑制Fe3+水解,防止所配制溶液变浑浊 |
| D | 二氧化硫通入溴水,溴水褪色 | 说明二氧化硫具有还原性 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
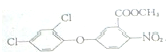
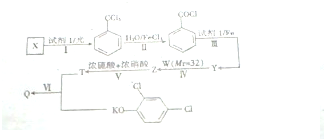

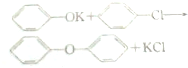
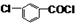 +CH3OH→
+CH3OH→ +HCl.
+HCl. .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH3CH2CHBrCH2Br | B. | CH3CH(CH2Br)2 | C. | CH3CHBrCHBrCH3 | D. | (CH3)2CBrCH2Br |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
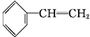 +Br2
+Br2
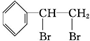 .
. $\stackrel{稀,冷KMnO_{4},溶液/OH-}{→}$
$\stackrel{稀,冷KMnO_{4},溶液/OH-}{→}$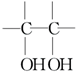 .请写出A与稀、冷的KMnO4溶液在碱性条件下反应的化学方程式
.请写出A与稀、冷的KMnO4溶液在碱性条件下反应的化学方程式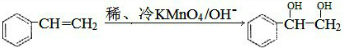 .
. .
.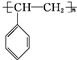 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
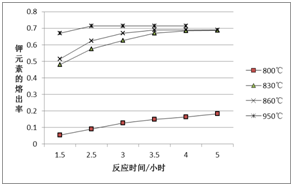 一定温度范围内用氯化钠熔浸钾长石(主要成份为KAlSi3O8)可制得氯化钾,主要反应是:NaCl(l)+KAlSi3O8(s)?KCl(l)+NaAlSi3O8(s)+Q.
一定温度范围内用氯化钠熔浸钾长石(主要成份为KAlSi3O8)可制得氯化钾,主要反应是:NaCl(l)+KAlSi3O8(s)?KCl(l)+NaAlSi3O8(s)+Q.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com