
| A、电池总反应的离子方程式为:Mg+H2O2+2H+=Mg2++2H2O |
| B、正极的电极反应为:H2O2+2H++2e-=2H2O |
| C、工作时,正极周围海水的pH减少 |
| D、电池工作时,溶液中的H+向负极移动 |


科目:高中化学 来源: 题型:
| A、X、Y分子式中氢原子数一定相同,与碳原子数的多少无关 |
| B、若X为CH4,则相对分子质量最小的Y是甲醇 |
| C、若X为CH4,则相对分子质量最小的Y是乙二醇 |
| D、X、Y的分子式应含有相同的氢原子数,且相差n个碳原子,同时相差2n个氧原子(n为正整数) |
查看答案和解析>>
科目:高中化学 来源: 题型:
 将0.050mol SO2和0.030mol O2放入容积为1L的密闭容器中,在一定条件下发生如下反应:2SO2(g)+O2(g)?2SO3(g),△H=-196.64kJ/mol.
将0.050mol SO2和0.030mol O2放入容积为1L的密闭容器中,在一定条件下发生如下反应:2SO2(g)+O2(g)?2SO3(g),△H=-196.64kJ/mol.查看答案和解析>>
科目:高中化学 来源: 题型:
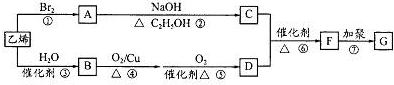
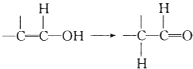 ,则E的结构简式为
,则E的结构简式为查看答案和解析>>
科目:高中化学 来源: 题型:
| n |
| 2 |
| 3n |
| 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 弱酸 | CH3COOH | HCN |
| pH | 3.4 | 5.6 |
| A、相同pH的两种酸溶液中,CH3COOH溶液中水电离的试c(H+)浓度较大 |
| B、物质的量浓度相同的CH3COONa与NaCN溶液中,CH3COONa溶液pH较大 |
| C、等体积pH相同的两种酸溶液,分别滴加NaOH溶液至恰好中和,消耗等量的NaOH |
| D、HCN的电离平衡常数(Ka)与CN-的水解平衡常数(K)存在如下关系:Ka?K=KW |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 温度/°C | K1 | K2 |
| 500 | 1.00 | 3.15 |
| 700 | 1.47 | 2.26 |
| 900 | 2.40 | 1.60 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| T(℃) | 700 | 800 | 830 | 1000 | 1200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
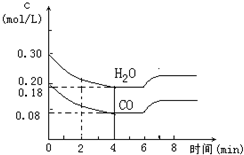
查看答案和解析>>
科目:高中化学 来源: 题型:
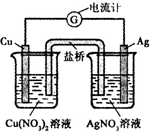 完成下列各题:
完成下列各题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com