
分析 (1)硫酸根离子和钡离子之间可以发生反应得到硫酸钡沉淀;加入氯化钡溶液检验硫酸根离子是否除尽;
(2)加入稍过量的碳酸钠溶液后将溶液过滤,滤液中含NaOH和Na2CO3两种杂质,可以加入盐酸除去,盐酸和氢氧化钠反应生成氯化钠和水,和碳酸钠之间反应生成氯化钠水以及二氧化碳.
解答 解:(1)加入过量氯化钡溶液除去硫酸根离子,检验硫酸根离子已除尽,可静止片刻在上层清液处,滴加一滴氯化钡溶液,不出现浑浊就说明硫酸根离子已经除尽,故答案为:氯化钡溶液;加入一定量BaCl2溶液后,静置,向上层清液中继续滴加BaCl2溶液,若无沉淀生成,则说明已沉淀完全.
(2)加入稍过量的碳酸钠溶液后将溶液过滤,滤液中含NaOH和Na2CO3两种杂质,可以加入盐酸除去,盐酸和氢氧化钠反应生成氯化钠和水,和碳酸钠之间反应生成氯化钠水以及二氧化碳,反应为:NaOH+HCl=NaCl+H2O; Na2CO3+2HCl=2NaCl+H2O+CO2↑.故答案为:NaOH+HCl=NaCl+H2O; Na2CO3+2HCl=2NaCl+H2O+CO2↑.
点评 本题考查在粗盐提纯的过程中所选用除杂和净化的方法,难度不大,除去杂质不要引入新的杂质,对于实验过程中过量的试剂都要除去.


科目:高中化学 来源: 题型:选择题
| A. | 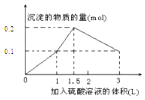 | B. | 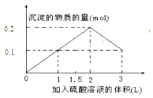 | ||
| C. | 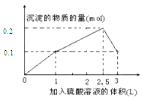 | D. | 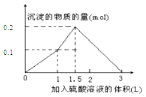 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
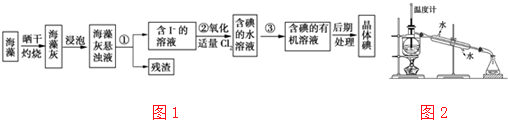
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①④②③ | B. | ④①②③ | C. | ②④①③ | D. | ④②①③ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
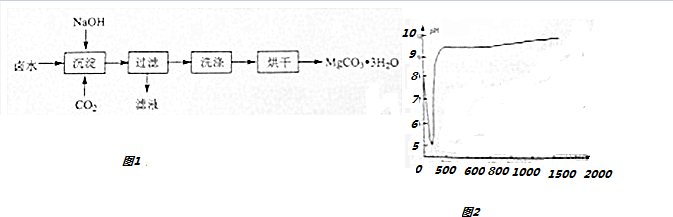
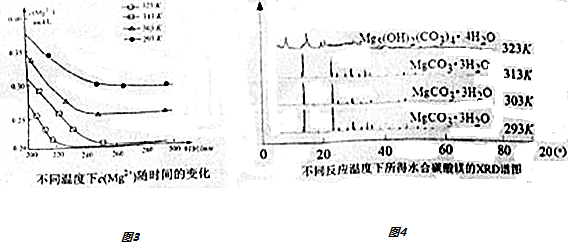
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 实验编号 | 操作 | 现象及结论 |
| a | 加入2mL蒸馏水,再加入10mL 5mol/L Na2S2O8溶液,振荡 | 红色固体逐渐溶解,先慢后快. |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 实验I | 实验II | 实验III | |
| 反应温度/℃ | 800 | 800 | 850 |
| c( A)起始/mol•L-1 | 1 | 2 | 1 |
| c( A)平衡/mol•L-1 | 0.5 | 1 | 0.85 |
| 放出的热量/kJ | a | b | c |
| A. | 化学平衡常数实验III的小于实验I的 | |
| B. | 实验放出的热量关系为b>2a | |
| C. | 实验III 在30min达到平衡,用A表示此段时间的平均反应速率v (A)为0.005mol•L-1•min-1 | |
| D. | 当容器内气体密度不随时间而变化时上述反应已达平衡 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com