
| A. | 葡萄糖浓度太浓 | B. | 加热时间不够 | C. | NaOH的量太少 | D. | CuSO4的量太少 |
分析 醛基能和新制的Cu(OH)2反应,该反应的本质是:醛基具有还原性,新制的氢氧化铜具有氧化性,醛基与氢氧化铜中的+2价的铜发生氧化还原反应,操作的关键是碱要过量,据此即可解答.
解答 解:A.葡萄糖和新制的Cu(OH)2反应,该反应的本质是:葡萄糖中的醛基具有还原性,新制的氢氧化铜具有氧化性,醛基与氢氧化铜中的+2价的铜发生氧化还原反应,只要有醛基即可反应,与葡萄糖溶液浓稀无关,故A错误;
B.葡萄糖和新制的Cu(OH)2反应:CH2OH(CHOH)4CHO+2Cu(OH)2 $\stackrel{水浴}{→}$CH2OH(CHOH)4COOH+Cu2O+2H2O,只要加热即可,故B错误;
C.n(CuSO4)=0.5mol/L×0.004L═0.002mol,根据反应CuSO4+2NaOH═Cu(OH)2↓+Na2SO4可知:n(NaOH)=2n(CuSO4)=0.004mol,n(NaOH)=0.5mol/L×V,V=8mL,应该加0.5mol/L NaOH溶液8mL,实际只加了4mL,NaOH溶液的量不够,故C正确;
D.n(NaOH)=0.5mol/L×0.004L=0.002mol,根据反应CuSO4+2NaOH═Cu(OH)2↓+2NaSO4可知:n(NaOH)=2n(CuSO4),n(CuSO4)=0.0001mol,应该加CuSO42mL,实际加了4mL,故D错误;
故选C.
点评 本题考查醛基的检验,解答时注意根据方程式中量的关系解题,题目难度不大.


 阳光课堂课时作业系列答案
阳光课堂课时作业系列答案科目:高中化学 来源: 题型:解答题
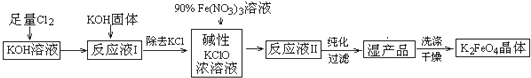
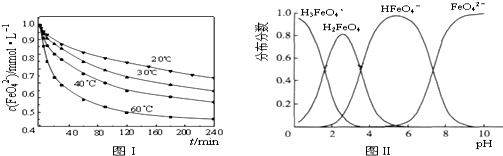
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
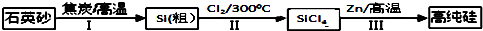
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温下,向醋酸溶液中加入少量的水,溶液中c(H+)将增大 | |
| B. | 常温下,pH相同的NaOH溶液和Ba(OH)2溶液中,水的电离程度相同 | |
| C. | 向NaHCO3溶液中加入少量的澄清石灰水,所得溶液的pH不变 | |
| D. | 常温下,2NO(g)+2CO(g)═N2(g)+2CO(g)能自发进行,则该反应的△H>0 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| 反应时间/s | 0 | 50 | 150 | 250 | 350 |
| n(PCl3)/mol | 0 | 0.16 | 0.19 | 0.20 | 0.20 |
| A. | 反应在前50s的平均速率v(PCl5)=0.0032mol•L-1•s-1 | |
| B. | 保持其他条件不变,若升高温度,反应重新达到平衡,平衡时c(PCl3)=0.11mol•L-1,则正反应的△H<0 | |
| C. | 相同温度下,若起始时向容器中充入1.0molPCl5和0.20 molCl2,在反应达到平衡前v(正)>v(逆) | |
| D. | 相同温度下,若起始时向容器中充入1.0molPCl5和1.0 molCl2,在反应达到平衡时PCl5的转化率为80% |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
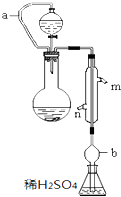 实验小组测定某肥料中的总氮含量(以氮的质量分数表示),实验装置如图(图中加热及夹持仪器略去).称取1.200g样品,通过化学方法将肥料中的氮转化成铵盐(除样品外,所加试剂均不含氮元素),然后在碱性溶液中蒸馏氨,用25.00mL浓度为0.5000mol•L-1硫酸溶液充分吸收,再用浓度为0.1000mol•L-1氢氧化钠溶液滴定未反应的硫酸.重复上述实验三次.实验数据如下:
实验小组测定某肥料中的总氮含量(以氮的质量分数表示),实验装置如图(图中加热及夹持仪器略去).称取1.200g样品,通过化学方法将肥料中的氮转化成铵盐(除样品外,所加试剂均不含氮元素),然后在碱性溶液中蒸馏氨,用25.00mL浓度为0.5000mol•L-1硫酸溶液充分吸收,再用浓度为0.1000mol•L-1氢氧化钠溶液滴定未反应的硫酸.重复上述实验三次.实验数据如下:| 实验 次数 | 氢氧化钠溶液的体积 | |
| 滴定前刻度(mL) | 滴定后刻度(mL) | |
| 1 | 0.00 | 5.22 |
| 2 | 6.00 | 11.18 |
| 3 | 12.00 | 17.20 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加酸性高锰酸钾溶液,振荡 | B. | 加NaOH溶液,加热 | ||
| C. | 加新制氢氧化铜悬浊液,加热 | D. | 加Na2CO3溶液,加热 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com